INTRODUCCIÓN
La medición de la presión arterial (PA) permite valorar el funcionamiento adecuado del cuerpo. Medir la PA en veterinaria se hacía de forma invasiva, lo que no era práctico para ser usado en el consultorio. En años recientes se dispone en el mercado medidores de PA de uso no invasivo como el ultrasonido Doppler y dispositivos oscilométricos (Haskins, 2015). La técnica oscilométrica ha demostrado tener una buena correlación con las técnicas invasivas de medición de la PA en perros (Vachon et al., 2014; Da Cunha et al., 2016) y gatos (Cerejo et al., 2017), principalmente en animales estables y de bajo riesgo (Cooper y Cooper, 2012).
Las técnicas oscilométricas para medir la PA arterial son actualmente las más usadas en animales pequeños, debido a que proporcionan la presión arterial sistólica (PAS), presión arterial diastólica (PAD), presión arterial media (PAM) y la frecuencia cardiaca (FC) (Da Cunha et al., 2016), además de no ser ruidosos, permitiendo que el animal se mantenga relajado durante el procedimiento. En perros se considera una PAnormal mediante el método oscilométrico de 131 ± 20 mmHg sistólica, 97 ± 16 media y 74 ± 15 mmHg diastólica; además, se considera que las hembras enteras presentan una menor PA que los machos enteros (Bodey y Michell, 1996). Los lugares para medir la PA con el dispositivo oscilométrico pueden ser en el antebrazo, base de la cola y por encima del tarso en decúbito dorsal, encontrándose una buena concordancia con las técnicas invasivas de medición de la PA, aunque las mediciones a nivel del antebrazo dieron las mejores concordancias (Fujiyamaet al., 2017).
Los monitores oscilométrico presentan un manguito que se infla automáticamente hasta que ocluye el flujo de la arteria, luego se desinfla lentamente y mide la PA media. Entonces, a partir de esta medida se calcula la PA sistólica y diastólica (Clarke et al., 2014). Puede presentarse cierta imprecisión en animales muy pequeños, con taquicardia, hipotensos o que se mueven mucho (Skelding y Valverde, 2020).
Se han reportado estudios que donde no han encontrado cambios entre la PA entre perras gestantes y no gestantes (Souza et al., 2017; Aguiar et al., 2018), aunque con pocos animales. Asimismo, se reporta un aumento de la FC con el aumento del tiempo de gestación, acompañado de un aumento del gasto cardiaco (GC) (Abbott, 2010; Blanco et al., 2012; Aguiar et al., 2018; Melandri et al., 2020), debido probablemente al aumento del volumen sanguíneo durante la gestación (Ward et al., 2020). No obstante, otros estudios no han encontrado diferencia entre la FC y GC en perras gestantes (Almeida, 2018; Ward et al., 2020). Ante esto, el objetivo de este trabajo fue determinar el efecto de la gestación sobre la PA y FC en perras gestantes sanas.
MATERIALES Y MÉTODOS
Se tomó la PA y FC a 156 perras de diversas razas que asistieron al Servicio de Ecografía de la Clínica de Animales Menores de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, Perú, entre agosto de 2018 a diciembre de 2019, para evaluar su gestación. De estas, 124 estaban gestando y 32 no gestando (en diestro). La edad varió entre 11 meses a 9 años, encontrando una hembra gestante de 9 años. Las razas que predominaron fueron Bulldog Inglés (n=103), Bulldog Francés (n=13), American Bully (n=8), Pug (n=4), Chihuahua (n=4), Shih Tzu (n=3), York shire (n=3), Mestiza (n=3), Schnauzer gigante (n=2), Jack Russell (n=2), y otras razas con un representante cada una.
A las pacientes se les realizó un examen clínico donde no evidenciaron alteraciones significativas. Se registró el peso, condición corporal, presencia/ausencia de edema subcutáneo y edad de la perra. Se complementó con un estudio ecográfico de gestación con un ecógrafo Samsung Medison Sono Ace Pico, con transductor microconvexo multifrecuencia 4-9 MHz y un convexo multifrecuencia de 3-7 MHz, con el que se calculó el tiempo de gestación, número de fetos, presencia de hidropesía fetal (anasarca, efusión pleural, efusión pericárdica y ascitis). Además, se les preguntó a los dueños sobre la paridad, enfermedades previas relacionadas con hipertensión arterial y tipo de dieta.
Para la condición corporal (CC) se usó la escala de 5, según Nelson et al. (2010). Las perras del estudio presentaron CC 2 (n=3), CC 3 (n=116) y CC 4 (n=5), de allí que se unió la CC 2 y CC3 como variable sin sobrepeso.
Las mediciones de PA se realizaron 5 minutos después de realizarse el estudio ecográfico, debido a que al finalizar este estudio los animales se encontraban más relajados. Se excluyeron del estudio a perras que se encontraban muy ansiosas y agitadas. Se midió la PA y la FC en el antebrazo derecho, en decúbito dorsal, sobre una colchoneta cóncava. Se utilizó un monitor SunTech Vet30(r). Se escogieron los manguitos de acuerdo con el grosor del antebrazo, considerando el ancho del manguito el 30-40% de la circunferencia del antebrazo (Acierno et al., 2018). Todas las medidas fueron realizadas por una sola persona. Se realizaron como mínimo 10 mediciones por paciente, eliminándose la primera y última medida.
Para el análisis estadístico se determinaron la media, mediana y desviación estándar. Los datos fueron sometidos a la prueba de Kolmorgoov-Smirnov para determinar si existe distribución normal. Se utilizó la prueba de Mann-Whitney para las comparaciones entre las variables. Se usó el programa IBM SPPSS Statistic 23 para los análisis estadísticos, considerando con un nivel del 5% de significancia.
RESULTADOS Y DISCUSIÓN
Se observó una variación significativa en la FC entre perras gestantes y no gestantes (Cuadro 1), concordando con otros estudios en perras (Blanco et al., 2012; Melandri et al., 2020) y en ratas (Conrad y Russ, 1992), aunque hay publicaciones donde no encontraron variación (Aguiar et al., 2018; Almeida et al., 2018; Ward et al., 2020). Vale indicar que en el presente estudio se utilizó un mayor número de perras gestantes que en aquellos publicados. Asimismo, se encontró que la FC presentó un aumento progresivo según avanza la gestación (Cuadro 2), resultados que concuerdan con los de Blanco et al. (2012), quienes reportan un aumento desde los 40 días de gestación. Por otro lado, no se encontró variación de la FC entre gestantes para las variables peso y sobrepeso, edad, número de fetos, presencia de hidropesía fetal y edema subcutáneo.
Cuadro 1 Distribución media ± desviación estándar y mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras gestantes y no gestantes
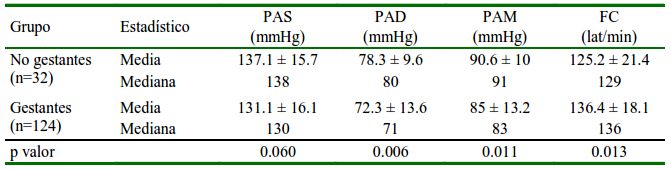
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
Cuadro 2 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras según el tiempo de gestación
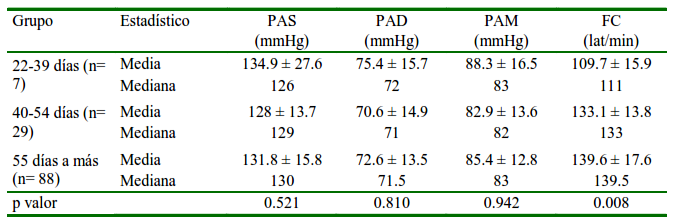
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
No se encontró diferencia significativa para la PAS entre perras gestantes y no gestantes (Cuadro 1), tal y como ha sido reportado (Sousa et al., 2017; Aguiar et al., 2018; Almeida et al., 2018), aunque puede observarse que se encuentra levemente disminuida en las gestantes. No obstante, se encontró diferencia significativa para la PAD y PAM, habiendo valores menores en perras gestantes (Cuadro 1), aunque sin diferencia entre las edades gestacionales (Cuadro 2), lo cual concuerda con Aguiar et al. (2018). En las gestantes se presenta una reducción de la resistencia vascular debido a una menor activación del sistema renina-angiotensina-aldosterona y un grado de refractariedad a la angiotensina II, ocasionando una menor PA a pesar del aumento del volumen sanguíneo (Conrad y Russ, 1992; Brooks et al., 2010).
No se encontró variación de la PA en perras con sobrepeso (Cuadro 3). Sin embargo, este resultado puede verse sesgado debido a que solo se tuvo cinco perras con sobrepeso moderado (CC 4). Se ha reportado que la obesidad produce un aumento de la PA en perros (Bodey y Michell, 1996), pero estos estudios no se realizaron en gestantes.
Cuadro 3 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras con y sin sobrepeso
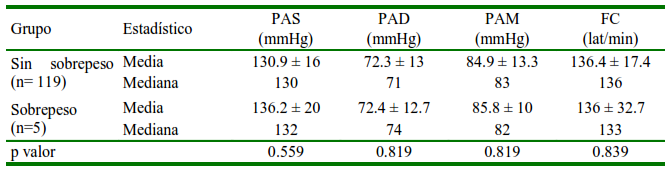
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
La edad de la madre no influyó en la PA (Cuadro 4). Solo nueve perras pertenecieron al grupo de 4 años a más. Las edades no fueron muy altas debido a que no se recomiendan gestaciones con perras mayores de siete años por el riesgo de distocia (Bergström et al., 2006; Cornelius et al., 2019). Bodey y Michell (1996) indicaron que en los perros la PA tiende a aumentar con la edad, semejante a lo que ocurre con las personas, ocasionado por un aumento gradual de la rigidez arterial (Pinto, 2007).
Cuadro 4 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras gestantes según el rango de edad
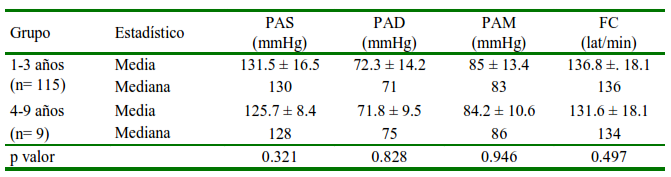
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
El número de fetos en una gestación no influenció la PAS, pero afectó la PAD y la PAM, observándose valores menores en gestaciones con más de 6 fetos (Cuadro 5). Esto concuerda con un estudio en ratas, donde se encontró una menor PA en gestaciones con mayor tamaño de camada (Ahokas y Sibai, 1990). Los autores no han encontrado estudios semejantes en perras.
Cuadro 5 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras gestantes según el número de fetos
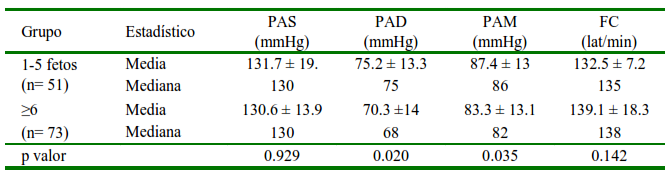
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
En el presente estudio se consideró a la hidropesía fetal debido a su alta presencia de casos; sin embargo, no se encontró diferencia de PA entre las gestaciones con y sin hidropesía (Cuadro 6). La hidropesía fetal es una alteración congénita donde se presenta acúmulo de líquido extravascular en dos o más cavidades o tejidos, presentándose como anasarca, efusión pleural, ascitis y efusión pericárdica (Society for Maternal-Fetal Medicine et al., 2015). En perros se desconoce la causa, aunque se observa generalmente en animales de raza braquiocefálica, y es raro encontrarlo en mestizos (Cahua y Cuesta, 2021). De las 33 gestaciones con hidropesía fetal en este estudio, 32 eran de raza Bulldog Inglés y una Exotic Bully, coincidiendo con la afirmación anterior y de otros autores (Hoskins, 2008; Sorribas et al., 2012).
Cuadro 6 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras gestantes con y sin hidropesía fetal
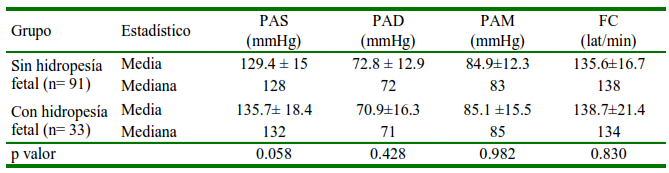
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
Se consideró la presencia de edema subcutáneo presente a nivel de las mamas. No se encontró variación de la PA en perras con edema subcutáneo (Cuadro 7), indicando que la PA no es un factor para la presencia de edema subcutáneo en perras gestantes. El edema subcutáneo durante la gestación se ha relacionado con perras de raza grande y camada numerosa, pero sin relación con hipoalbuminemia (Davidson, 2019). En este estudio, de las 45 perras con edema subcutáneo, 39 eran de raza Bulldog Inglés, 3 American Bully, 1 Bulldog Francés, 1 Bull Terrier y 1 Pug, no siendo de raza grande. Con respecto al tamaño de camada, 32 perras estuvieron en el grupo de 6 a más fetos y 13 en el grupo de 1-5 fetos, observándose una predominancia de edema en gestaciones camada numerosa, pero sin relación con hipoalbuminemia (Davidson, 2019). En este estudio, de las 45 perras con edema subcutáneo, 39 eran de raza Bulldog Inglés, 3 American Bully, 1 Bulldog Francés, 1 Bull Terrier y 1 Pug, no siendo de raza grande. Con respecto al tamaño de camada, 32 perras estuvieron en el grupo de 6 a más fetos y 13 en el grupo de 1-5 fetos, observándose una predominancia de edema en gestaciones de camada grande, aunque hubo 41 gestaciones de camada grande que no presentaron edema subcutáneo.
Cuadro 7 Distribución media ± desviación estándar, mediana de la presión arterial (PA) y frecuencia cardiaca (FC) en perras gestantes con y sin edema subcutáneo mamario
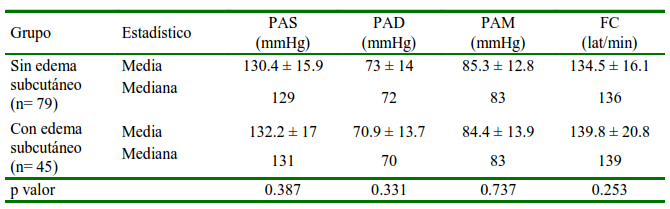
PAS: Presión arterial sistólica. PAD: Presión arterial diastólica. PAM: Presión arterial media
P valor: nivel de significancia al 95%
CONCLUSIONES
La frecuencia cardiaca es mayor en perras gestantes que en las no gestantes, presentando un aumento progresivo según aumenta el tiempo de gestación.
La presión arterial diastólica (PAD) y la presión arterial media (PAM) estuvieron influenciadas por la gestación y el tamaño de camada.
La presión arterial no se ve influenciada por la edad y sobrepeso de la perra gestante.
La presencia de edema mamario subcutáneo y la hidropesía fetal no están relacionados con la presión arterial.












 uBio
uBio 


