INTRODUCCIÓN
La producción de la concha de abanico es una actividad productiva intensiva, de modo que la alta densidad de individuos puede causar estrés y disminuir la respuesta inmune, aumentando el riesgo de transmisión de enfermedades (Murray y Peleer, 2005). Las enfermedades parasitarias en acuicultura se han asociado con unidades de producción con alta densidad de animales (Nowak, 2007).
Una de las principales enfermedades de los moluscos bivalvos de reporte obligatorio al OMSA (2016) es la perkinsosis, causada por Perkinsus marinus en Crassostrea virginica, detectada inicialmente en el Golfo de México (Tabasco) (Burreson et al., 1994) y en la costa oeste de los Estados Unidos (Ford, 1996). Posteriormente, Cremonte et al. (2005) reportaron Perkinsus olseni en almejas (Pitar rostrata) de Uruguay.
En la concha de abanico cultivada en Coquimbo-Chile (Argopecten purpuratus) se ha descrito la presencia de una larva de trematodo (digeneo) (Lohrmann et al., 1991), así como la larva de un cestodo (PUCV, 2005). Asimismo, Lohrmann (2009) en Chile encontró microcolonias intracelulares de bacterias (MCI) compatibles con organismos tipo Rickettsiales (RLO) en el epitelio de los túbulos de la glándula digestiva, infiltraciones hemocíticas en branquias, granulomas y un protozoo ciliado Trichodina sp en conchas de abanico. La denominación RLO se cambió a ELO (organismos tipo Endozoicomonas), debido al estudio de Cano et al. (2020) donde demostraron estos microorganismos mediante PCR específica e hibridación in situ.
En Perú y Chile se han descrito larvas de trematodos (digeneos) que provocan daños en branquias y tejido ovárico provocando infertilidad en especies acuícolas (FONDEPES, 2004). Sin embargo, no se han reportado casos de mortalidad masiva en conchas de abanico peruanas (Argopecten purpuratus) causadas por parásitos. No se dispone de mucha información sobre los parásitos presentes en las poblaciones de concha de abanico cultivadas o silvestres, por lo que se requiere conocer los agentes parasitarios y las lesiones histopatológicas que provocan dichos agentes, a fin de establecer programas de prevención y control de enfermedades en los centros de cultivo de Argopecten purpuratus.
MATERIALES Y MÉTODOS
Diseño del Estudio
Esta investigación fue de tipo analítico longitudinal, donde la estación del año y la procedencia de las muestras fueron las variables independientes, y la frecuencia de microorganismos parasitarios y las lesiones microscópicas las variables dependientes.
Muestras
Se consideraron dos grupos de moluscos: silvestres (no cultivados) y provenientes de la acuicultura, y obtenidos en dos épocas del año: verano (enero, febrero y marzo) e invierno (junio, julio y agosto). Los moluscos fueron colectados en el distrito de Samanco, ubicado en Chimbote, Ancash, en el centro norte del Perú. Los especímenes fueron procesados en el Laboratorio de Parasitología e Histología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Peruana Cayetano Heredia (UPCH), en Lima. Se estudiaron 90 moluscos por grupo, siendo estos: (a) Concha de abanico de vida libre en verano (CALV), (b) Concha de abanico de vida libre en invierno (CALI), (c) Concha de abanico de acuicultura en verano (CAAV) y (d) Concha de abanico procedente de acuicultura en invierno (CAAI). En total fueron 360 animales.
Técnicas y Procedimientos
Muestreo
Los bivalvos se recolectaron sin distinguir entre individuos sanos y enfermos en los dos lugares de procedencia y en las dos épocas del año. Los especímenes cultivados procedieron de tres empresas dedicadas a esta crianza y los de vida libre fueron extraídas de su medio natural mediante buceo. Los animales, una vez sacados del agua, se mantuvieron en cajas de poliestireno expandido (Tecnopor) conteniendo bolsas de hielo para evitar el deterioro de los tejidos y completamente cerradas para evitar que se deshidraten las muestras (OMSA, 2016) hasta su traslado al laboratorio.
Se midió el oxígeno, salinidad, pH y temperatura del agua de la bahía de Samanco en forma semanal para obtener promedios mensuales. Se empleó el equipo portátil multiparámetro Hanna Hi 9829.
Estudio histopatológico
Se realizaron dos cortes paralelos en cada muestra, quedando divididas en tres regiones. Se tomó la región central que incluye los órganos (branquias, ovario, testículo, glándula digestiva, manto y nefridios) de los moluscos del género Argopecten sp (NOAA, 2004). Las muestras fueron preservadas en la solución de Davidson por 24 horas y luego en etanol al 50% hasta su procesamiento (OMSA, 2016).
Las muestras se trabajaron mediante el procesamiento histológico convencional con la tinción de hematoxilina y eosina, obteniéndose 360 láminas, que fueron observadas en el microscopio óptico (Leica DM750) para determinar las lesiones histopatológicas y para la toma de fotografías (Leica ICC56 HD). Las lesiones se clasificaron según el porcentaje de área afectada en el órgano evaluado, reportándose en un nivel que va del 1 al 4 (Reimschuessel et al., 1992) (Cuadro 1). Los resultados se presentaron como frecuencias, donde se indica el porcentaje de cada tipo de lesión según el total de muestras analizadas. Para la identificación de los parásitos se usaron diversas fuentes bibliográficas (PUCV, 2004; Lohrmann, 2009; Bozzo et al., 2015).
Cuadro 1 Clasificación de las lesiones según el porcentaje de área comprometida en la muestra (lámina histopatológica) (Reimschuessel et al., 1992).

Los datos se analizaron mediante la prueba de Chi cuadrado para determinar posibles asociaciones entre las lesiones histopatológicas, los agentes parasitarios encontrados, el lugar de origen y la estación del año.
Consideraciones éticas
La investigación fue aprobada por la UPCH (Expediente N.° 100170) y con la debida autorización de las empresas productoras de concha de abanico.
RESULTADOS
En el verano, la temperatura más alta (25.76 °C) en el agua se presentó en febrero y la mayor cantidad de oxígeno disuelto - OD (8.71 ml/l) en enero, mientras que en el invierno la temperatura más baja (17.67 °C) y el mayor nivel de OD (11.38 ml/l) se registraron en agosto. Asimismo, se observó una relación inversa entre el nivel de OD y la temperatura en el agua (Figura 1). Los valores de pH y salinidad se encontraron constantes y dentro del rango normal de producción para la concha de abanico.
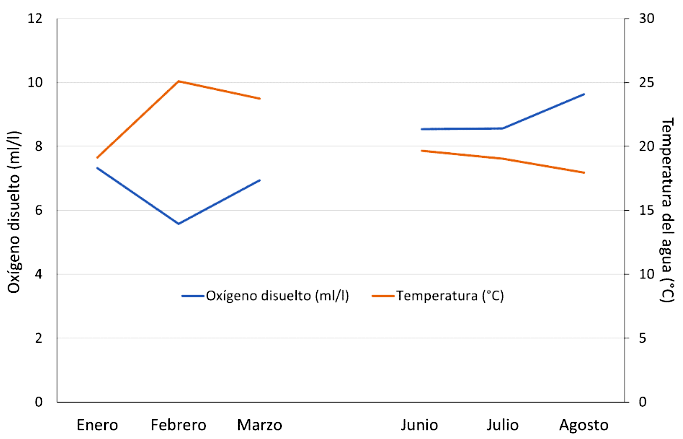
Figura 1 Relación inversamente proporcional entre el oxígeno disuelto y la temperatura del agua en la bahía de Samanco en Áncash
Se encontraron lesiones histopatológicas en todos los órganos evaluados (Figuras 2-9). Los órganos que presentaron más lesiones fueron la glándula digestiva y las branquias. También se observaron diferencias en frecuencias en los tipos de lesiones entre grupos (Cuadro 2).
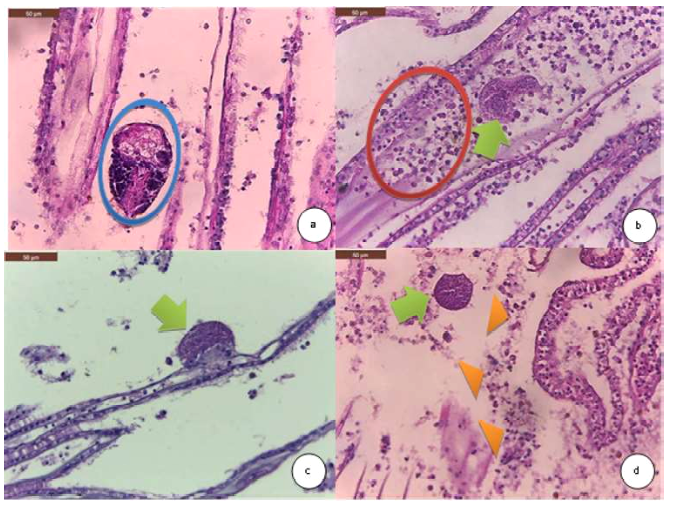
Figura 2 Hallazgos histopatológicos en branquias de la concha de abanico Argopecten purpuratus. (a) Escasos trematodos entre los filamentos branquiales (círculo azul) H&E. 400X. (b) Moderadas microcolonias intracelulares (MCI) dentro de un vaso linfático en branquias (flecha verde) y moderada infiltración de los hemocitos (círculo rojo). H&E. 400X. (c) MCI en el epitelio branquial (flecha verde) H&E. 400X. (d) Moderadas MCI en branquias, Moderadas zonas de necrosis de los filamentos branquiales (cabezas de flecha morado) H&E. 400X
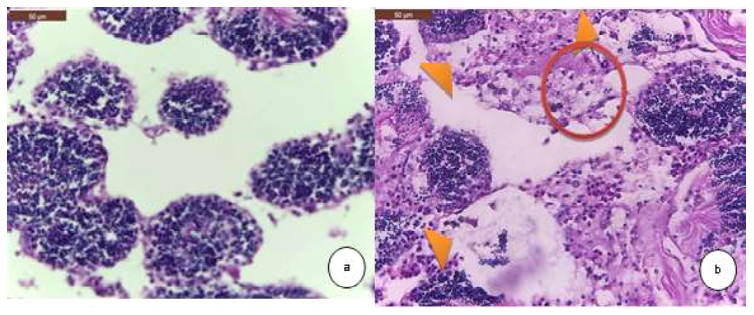
Figura 3 Hallazgos histopatológicos en gónada masculina de la concha de abanico Argopecten purpuratus. (a) Leve atrofia de la gónada masculina (reducción del parénquima testicular). H&E. 400X. (b) Leve infiltración hemocítica (círculo rojo) y necrosis de los túbulos seminíferos (cabezas de flecha anaranjadas). H&E. 400X
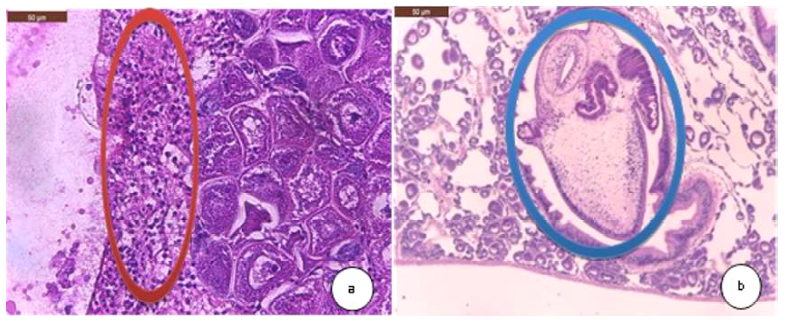
Figura 4 Hallazgos histopatológicos en gónada femenina de la concha de abanico Argopecten purpuratus. (a) Leve infiltración de hemocitos (círculo rojo). H&E. 400X. (b) Escasos trematodo en gónada femenina (círculo azul) y atrofia de la gónada femenina (reducción del parénquima ovárico). H&E. 400X
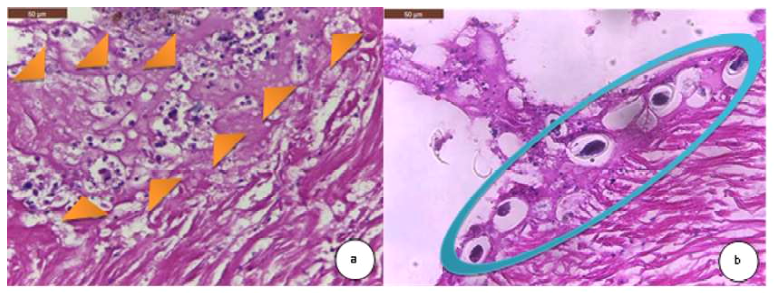
Figura 5 Hallazgos histopatológicos en músculo aductor de la concha de abanico Argopecten purpuratus. (a) Moderada necrosis del tejido muscular (cabeza de flechas anaranjadas). H&E. 400X. (b) Leve presentación de ooquistes de Nematopsis sp entre las fibras musculares (círculo celeste). H&E. 400X
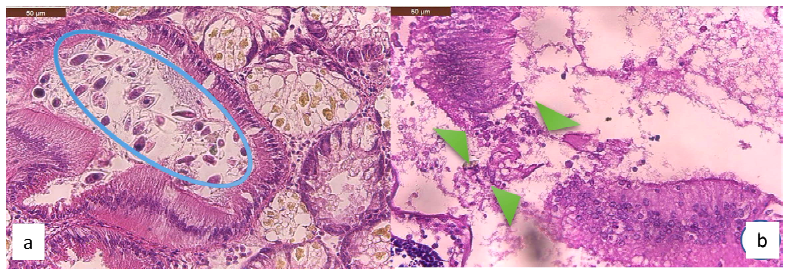
Figura 6 Hallazgos histopatológicos en intestino de la concha de abanico (Argopecten purpuratus). (a) Moderada presentación de ooquistes de Nematopsis sp en el lumen de los intestinos (círculo celeste). H&E. 400X. (b) Leve necrosis en el epitelio intestinal (cabeza de flechas verdes). H&E. 400X
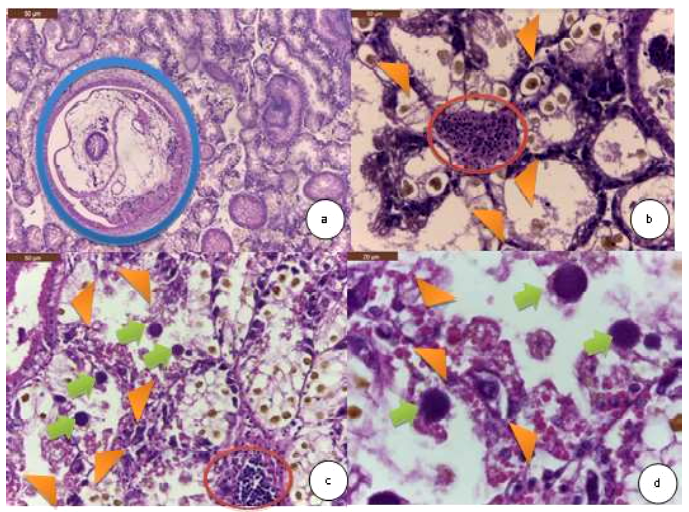
Figura 7 Hallazgos histopatológicos en glándula digestiva de la concha de abanico Argopecten purpuratus. (a) Cestodo en las glándulas (círculo azul). H&E. 100X. (b) Moderada infiltración de hemocitos entre las glándulas (círculo rojo), pérdida de la citoarquitectura y el detalle celular del epitelio glandular (cabeza de flechas anaranjadas). H&E. 400X. (c) Severa cantidad de microcolonias intracelulares (MCI) en glándula digestiva (flechas verdes), severa necrosis (cabeza de flechas anaranjadas), moderada infiltración hemocítica (círculo rojo). H&E. 400X. (d) Severa cantidad de MCI en glándula digestiva y severa necrosis (cabeza de flechas anaranjadas). H&E. 1000X
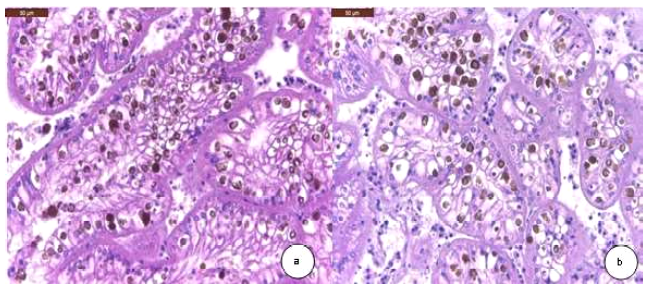
Figura 8 Hallazgos histopatológicos encontrados en nefridios de la concha de abanico Argopecten purpuratus. (a y b) Se observan moderadas concreciones (color café) en el citoplasma de las células. H&E. 400X
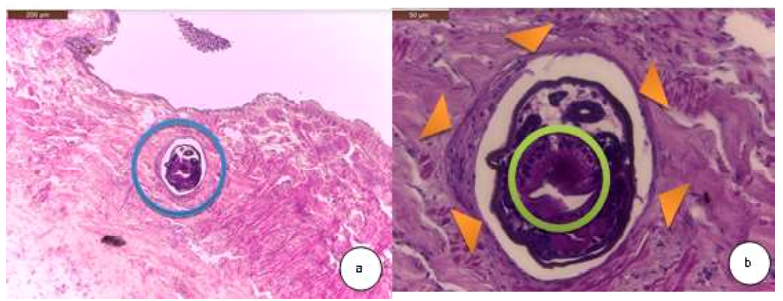
Figura 9 Hallazgos histopatológicos manto de la concha de abanico Argopecten purpuratus. (a) Leve infección con trematodo en manto (círculo azul). H&E. 100X. (b) Se observa los hemocitos alargados tratando de arrestar al trematodo (cabezas de flecha anaranjadas): Se puede identificar el tubo digestivo del metazoario. H&E. 400X
Cuadro 2 Lesiones histopatológicas en órganos de Argopecten purpuratus silvestres y cultivadas en la bahía de Samanco (Áncash, Perú), según la procedencia y la época del año
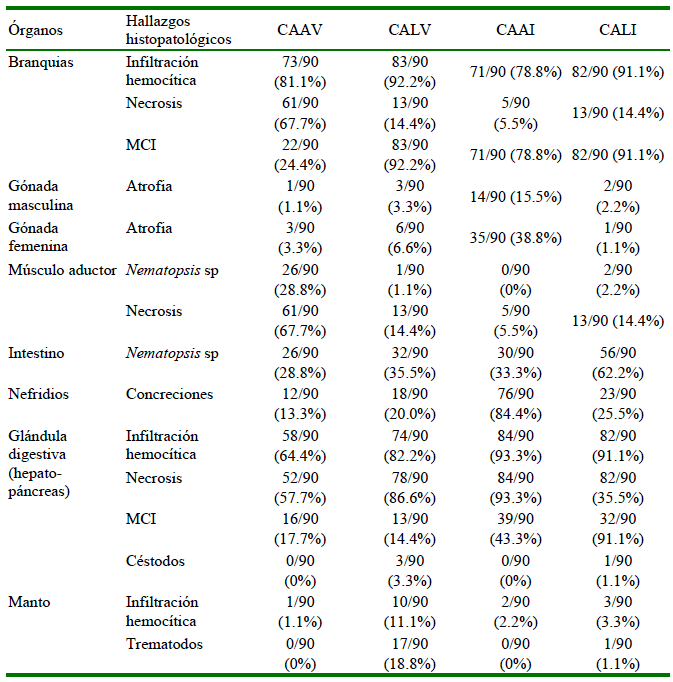
CAAV: Acuacultura en verano, CALV: Vida libre en verano, CAAI: Acuacultura en invierno, CALI: Vida libre en invierno
MCI: Microcolonias intracelulares
La necrosis en branquias, la infiltración de hemocitos en branquias y las concreciones en nefridios presentaron una asociación significativa con el origen (acuicultura o vida libre). En forma similar, se observó una asociación significativa con concreciones en nefridios e infiltración de hemocitos en la glándula digestiva con la temporada del año (invierno y verano) (Cuadros 3 y 4).
Cuadro 3 Asociación entre la procedencia o época del año con la prevalencia de microorganismos parasitarios en órganos de la concha de abanico Argopecten purpuratus

DISCUSIÓN
El aumento de la temperatura del mar, acompañado de una disminución del oxígeno disuelto, se debió al fenómeno de El Niño, el cual afectó a la costa norte peruana (ENFEN, 2017). La relación inversamente proporcional que existe entre el nivel del oxígeno disuelto y la temperatura del agua causa que en los meses de mayor temperatura el oxígeno disuelto desciende provocando estrés en los animales (Roldán, 2003).
En las branquias se encontró prevalencias altas de infiltración de hemocitos en los cuatro grupos estudiados y en esos mismos órganos se encontró las MCI, las cuales producen una respuesta inflamatoria en el molusco. En el grupo de conchas de abanico de acuicultura en verano (CAAV) no se encontró una alta prevalencia de MCI, pero fue el grupo con mayor porcentaje de necrosis en branquias, de allí que se presume que los causantes de estas lesiones sean los MCI, ya que en su multiplicación causan muerte celular por citólisis y es más difícil poder detectarlos por histopatología, a diferencia cuando se encuentran infectando una célula y su observación es más fácil ya que causan citomegalia (Wen et al., 1994). Los MCI observados fueron compatibles con RLO, como se menciona en estudios previos (PUCV, 2004; Lohrmann, 2009).
La respuesta inflamatoria en moluscos a los RLO proviene inicialmente de los hemocitos (Hoffmann et al., 1999), los cuales fagocitan o forman una cubierta para encapsular a los agentes extraños (Bozzo et al., 2015). En el presente estudio se encontró que la presencia de MCI compatibles con RLO solo estuvo asociada con la época del año, donde hubo una mayor frecuencia de moluscos infectados en el verano, donde ocurre un incremento de la temperatura y una disminución del nivel del oxígeno disuelto, posiblemente debido a factores de estés (PUCV, 2010).
La infiltración de hemocitos y necrosis en branquias se observó en todos los grupos, habiendo una asociación significativa con la procedencia, ya que las conchas de abanico de vida libre fueron las más afectadas. Esto podría deberse a la mayor exposición a diferentes compuestos orgánicos descritos por IMARPE (2008) en los moluscos que habitan en la bahía de Samanco.
En el caso de los testículos y ovarios, la prevalencia de lesiones fue bajo con excepción del grupo CAAI, donde se observó 15.5% (14/90) y 38.8% (35/90), respectivamente, de atrofia en los moluscos. Las atrofias observadas podrían ser fisiológicas, ya que las lesiones no estuvieron acompañadas de una infección severa por parásitos o por reacciones inflamatorias. La atrofia fisiológica de las gónadas ocurre después del desove (Daniel-Lemus et al., 2014).
Lo que se encontró en el músculo aductor fue una alta prevalencia de Nematopsis sp en el grupo CAAV. Asimismo, la necrosis se observó en todos los grupos; especialmente en los grupos de verano (CAAV y CALV). Los ooquistes de Nematopsis sp no provocan daños significativos en bivalvos (Meyers y Burton, 2009) de allí que los daños tisulares encontrados podrían haber sido provocados por otras causas.
En intestino se halló una mediana prevalencia de Nematopsis sp en todos los grupos, siendo mayor en el grupo CALI (62.2%, 56/90). Meyers y Burton (2009) encontraron organismos parecidos a Nematopsis sp a nivel intestinal de la ostra del Pacífico (Crassostrea gigas) provocando daños tisulares leves.
En lo nefridios se encontraron concreciones en todos los grupos, destacando el grupo CAAV con una prevalencia de 84.4% (76/ 90). Las concreciones mostraron asociación significativa tanto con la procedencia como con la estacionalidad. Es decir, las conchas de abanico procedentes de la acuicultura y en época de invierno presentaron una mayor acumulación de concreciones en su sistema excretor. Los nefridios están revestidos por células epiteliales que tienen una vacuola con una concreción (gránulo de excreción) (Lohrmann, 2009), conformadas principalmente por fosfato de calcio (Shumway y Parsons, 2016). Diferentes especies expuestas a elementos orgánicos provocan un aumento en producción de concreciones, incluyendo los metales pesados (Fowler y Gould, 1988; Camichael y Fowler, 1981). IMARPE (2008) evidenció la presencia de materia orgánica como fosfatos, nitritos y nitratos, los cuales provenían de las actividades del cultivo, metales pesados (cobre, plomo y cadmio) en la bahía de Samanco, así como en los animales que muestrearon.
En la glándula digestiva se encontró MCI compatibles con RLO, especialmente en los grupos CAAI y CALI. Asimismo, el igual que en el caso de las branquias, este tipo de hallazgos estuvo asociado a la época del año, donde hubo mayor frecuencia de casos en invierno. Similar resultado se encontró en un estudio de Pecten maximus donde se determinó la mayor intensidad de infección de rickettsiosis en invierno (Le Gall et al., 1991). En forma similar, casos de necrosis e infiltración hemocítica se asociaron con la época invernal, tal y como fue reportado por Le Gall et al. (1991).
En 2020 se estudiaron muestras de concha de abanico de Chile para caracterizar estos organismos denominados RLO y con análisis filogenéticos e hibridación in situ (ISH) se determinó que existían secuencias de Endozoicomonadaceae, por lo que se cambió el nombre a ELO (Endozoicomonas like organismos) (Cano et al., 2020). Estos microorganismos probablemente también estén presentes en las conchas de abanico peruanas, por lo que es necesario realizar estudios filogenéticos sobre las MCI encontradas en estas especies.
En el manto se determinó asociación significativa entre la infección de trematodos con la procedencia de los moluscos, donde los animales de vida libre fueron los más afectados, debido a la mayor posibilidad de contacto con este tipo de parásitos. Asimismo, hubo asociación significativa con la época de verano, toda vez que las temperaturas cálidas del agua favorecen la presentación de las enfermedades parasitarias (Bozzo et al., 2015). Infestaciones similares han sido reportadas en conchas de abanico en Chile (Lohrmann, 2009).
CONCLUSIONES
Existen parásitos como trematodos y microcolonias intracelulares de bacterias (MCI) compatibles con organismos tipo Rickettsiales (RLO) en conchas de abanico Argopecten purpuratus independientemente de su origen (acuicultura o vida libre) y durante las épocas de verano e invierno en la zona de Samanco, Áncash, Perú.
Los tejidos más afectados por MCI compatible con RLO en las conchas de abanico fueron la glándula digestiva y las branquias.
Los trematodos afectaron al manto, y la mayor prevalencia estuvo asociada con la procedencia de los moluscos (vida libre).












 uBio
uBio 



