INTRODUCCIÓN
La prevención y el control de las enfermedades zoonóticas requieren entender del papel de los animales domésticos en la transmisión de los agentes infecciosos. En especial en Sudamérica, donde se presentan condiciones demográficas y socioeconómicas que incrementan los desafíos relacionados con las interacciones en la interfaz entre la salud animal y humana (Schneider et al., 2011; Azócar-Aedo, 2023). Especial atención reciben los canes domésticos que pueden ser reservorios de microorganismos zoonóticos y su tenencia ha sido descrita en estudios epidemiológicos como factor predisponente para la transmisión de enfermedades al hombre (Schurer et al., 2014; Ortega-Pacheco et al., 2017a).
Por otro lado, las enfermedades infecciosas son un factor natural que regulan las poblaciones silvestres (De Almeida Curi et al. 2010), donde ciertos agentes infecciosos y bajo ciertos factores ambientales (pérdida de hábitat, explotación de recursos, cambio climático, etc.) pueden ser una amenaza para la conservación de la fauna (McKnight et al. 2017; Scheele et al., 2019). En este sentido, los agentes patógenos de animales domésticos como los canes pueden afectar a una diversidad de especies silvestres (Costanzi et al., 2021), en especial si tienen acceso a áreas naturales protegidas. Los canes domésticos son los principales reservorios de agentes infecciosos, como Toxoplasma gondii y Leptospira spp, que afectan a carnívoros silvestres, especialmente en bosques naturales (de Almeida Curi et al., 2010, 2016).
T. gondii es un protozoario cosmopolita y está presente en una diversidad de animales, incluyendo al ser humano (Dubey, 2010), siendo una enfermedad de gran importancia en salud pública, llegando a infectar a un tercio de la población humana (Flegr et al., 2014). La propagación se produce por consumo de carne cruda de animales infectados o de alimentos contaminados con ooquistes. A diferencia de los gatos, la presentación clínica en canes es primaria y puede estar asociada a otras enfermedades (Dubey et al., 2009). En comunidades rurales, la frecuencia de toxoplasmosis en canes es alta, reportándose en México una prevalencia de 97%, posiblemente relacionada a la contaminación ambiental como consecuencia de periodos de alta eliminación de ooquistes por parte de los gatos (Ortega-Pacheco et al., 2017a).
Leptospira spp es causante de leptospirosis, considerada una enfermedad emergente (Kuhn, 2003). Se presenta en mamíferos silvestres y domésticos como el perro, este último considerado como un reservorio importante. La infección se produce por contacto directo con la orina o por exposición ambiental a fuentes de agua contaminadas (Thibeaux et al., 2017; Azócar-Aedo, 2023). Se han descrito alrededor de 200 serovares de L. interrogans, siendo Canicola, Gryppotyphosa, Icterohaemorrhagiae, Pomona, Autumnalis y Bratislava catalogadas con potencial zoonótico (Monahan et al., 2009). En comunidades rurales la prevalencia en canes es variable, siendo de 45% en México (Ortega-González et al., 2018) hasta 100% en Brasil (Aguiar et al., 2007).
Las poblaciones humanas de escasos recursos y marginadas tienen mayores probabilidades de infección, debido a su baja situación socioeconómica y a la falta de higiene (Molyneux et al., 2011). Esta situación podría presentarse en las comunidades del Perú, como la Comunidad Campesina de Corosha, ubicada en el departamento de Amazonas. Los pobladores de esta comunidad se dedican a la agricultura y ganadería, con tenencia de canes domésticos que tienen acceso al bosque nuboso que los rodea. Sin embargo, se desconoce la presencia de Leptospira spp o T. gondii en estos animales. Ante esto, el obtenido del presente estudio fue identificar el rol de los canes como reservorios de Leptospira spp y T. gondii en la Comunidad Campesina de Corosha, determinando la prevalencia, y las características epidemiológicas y de tenencia asociadas a la seropositividad de los canes.
MATERIALES Y MÉTODOS
Lugar de Estudio
La investigación se realizó en la comunidad campesina de Corosha, localizada en el distrito de Corosha, provincia de Bongara, departamento de Amazonas (5°502'263´´S 77°292´203´´O). La comunidad está compuesta por 250 familias, dedicadas principalmente a la agricultura y ganadería. La zona central de la comunidad está rodeada por un bosque húmedo de altura que está protegido en el Área de Conservación Privada Hierba Buena. El área protegida es hábitat de una diversidad de mamíferos de alta importancia como el oso de anteojos (Tremarctos ornatus), el puma (Puma concolor), el mono endémico del Perú y el mono choro de cola amarilla (Oreonax flavicauda).
Población y Muestra
La comunidad tiene una población de 150 canes domésticos. El tamaño de la muestra calculó mediante la fórmula para estimar una proporción mediante el programa Epidat v. 4.2, considerando 95% de confianza y prevalencias referenciales de 67% para Leptospira (Céspedes et al., 2003) y de 50% para T. gondii (Cedillo-Peléz et al., 2011), lo que resultó en tamaños muestrales de 55 y 54 individuos, respectivamente. No obstante, para el caso del estudio de Toxoplasma gondii, se analizaron muestras de 62 canes.
Toma de Muestra
El estudio contó con el permiso de investigación de la Escuela de Medicina Veterinaria de la Facultad de Ciencias Agropecuarias de la Universidad Alas Peruanas (015-2018-FMV-UAP). El tipo de muestreo fue no probabilístico por conveniencia, para lo cual se visitaron las casas de la comunidad, buscando identificar a aquellos miembros con tenencia de canes que aceptasen participar en el estudio, firmando el formulario de consentimiento informado. La toma de muestra se realizó en el mes de agosto de 2018.
Se aplicó un cuestionario para recoger información sobre los canes: a) categoría de edad (cachorro, adulto o geronte), b) sexo (hembra o macho), c) origen (local si nació en la misma comunidad o foráneo si proviene de fuera de la comunidad), d) vacunación (sí/ no y tipo de vacuna), e) atención veterinaria (sí o no, en algún momento de su vida), f) f) acceso al río (sí o no), g) acceso a zonas cultivadas (sí o no) y h) actividad de caza o acceso a alimentos crudos (sí o no).
Se colectó 3 ml de sangre por punción de la vena cefálica, en un tubo de colecta sin anticoagulante (BD Vacutainer(r)). Las muestras fueron centrifugadas a 2000 rpm durante 10 minutos para obtener el suero, el cual fue alicuotado en dos microtubos estériles y conservados a -20 ºC hasta su envío al laboratorio en la ciudad de Lima.
Diagnóstico de Leptospira
En el Laboratorio de Microbiología y Parasitología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos se analizaron 55 muestras de suero canino mediante la prueba de aglutinación microscópica (MAT), prueba estándar para Leptospira (sensibilidad: 92%; especificidad: 95%) (Medrano et al., 2011). Se evaluó la presencia de anticuerpos contra Leptospira para los serovares Bratislava, Canicola, Georgia, Grippotyphosa, Icterohae-morrhagiage y Pomona. Se consideró positivo a los individuos con títulos de anticuerpos igual o superior a 1/100. Se consideró como coaglutinación títulos iguales frente a diferentes serovares (Siuce et al., 2015).
Diagnóstico de T. gondii
En el Laboratorio de Parasitología de la Facultad de Ciencias Agropecuarias de la Universidad Alas Peruanas se analizaron 62 muestras de suero canino mediante la prueba de hemaglutinación indirecta (HAI), utilizando el kit Toxotest -HAI (Wiener Lab), que detecta anticuerpos Ig G frente a T. gondii (especificidad: 96%; sensibilidad: 95%). Se siguieron las indicaciones del fabricante y se consideraron positivos los valores superiores o iguales a 1/32 (punto de corte).
Análisis Estadístico
Se determinó la seroprevalencia e intervalo de confianza al 95% de T. gondii y de Leptospira spp, así como de los cinco serovares analizados. Además, para determinar la asociación entre las variables (edad, sexo, vacunación, atención veterinaria, acceso al río, acceso a zonas cultivadas y actividad caza, acceso a alimentos crudos) y la seropositividad de los animales se empleó la prueba de Chi cuadrado mediante el programa estadístico STATA v. 16. 2020, considerándose significativa una p<0.05.
RESULTADOS
Se entrevistó a 48 propietarios de canes. El 79.2% (38/48) tenía uno, 14.6% (7/48) tenía dos y 6.3% (3/48) tenía de 3 a 5 canes. La edad de los animales varió entre los 4 meses y los 15 años (Cachorros; 24.2%; Adultos: 72.6%; Gerontes: 3.3%), siendo 61.3% machos.
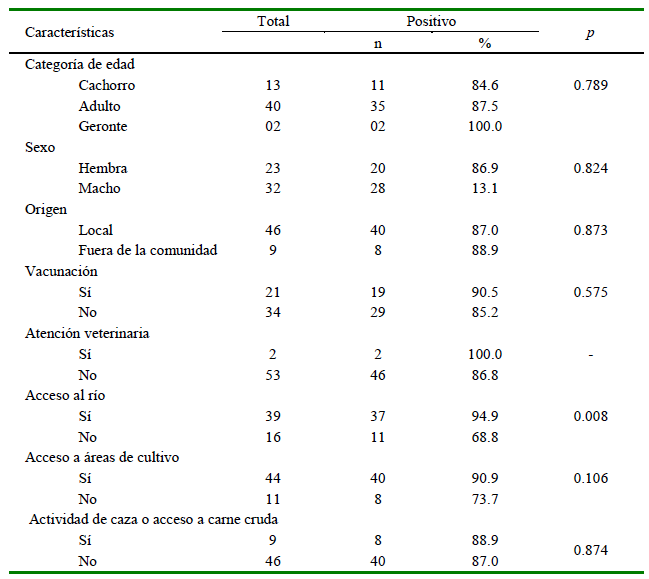
La seroprevalencia para Leptospira spp fue de 82.3% (48/55), siendo el serovar Grippotyphosa el más frecuente (58.2%), seguido de Icterohaemorrhagiae (54.6%), Pomona (40%), Canicola (32.7%), Bratislava (30.9%) y Georgia (21.8%) (Cuadro 1). Se identificaron 14 coaglutinaciones, considerando reacciones a dos serovares con título iguales (todos a 1/100), predominando Ictero-haemorrhagiae-Grippotyphosa (26.7%) e Icterohaemorrhagiae-Pomona (26.7%) (Cuadro 2). Se observó una mayor prevalencia en los canes con acceso al río (94.9%) en comparación con los individuos sin acceso (68.8%) (p=0.008). No se halló diferencias significativas para las demás variables evaluadas (Cuadro 3).
Cuadro 1. Prevalencia de Leptospira spp en canes de la Comunidad Campesina de Corosha Amazonas, Perú (2018) (n=55)
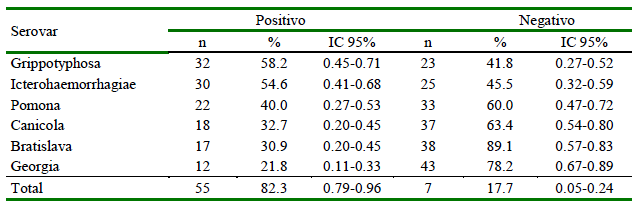
Cuadro 2. Coaglutinaciones de serovares de Leptospira spp en canes de la Comunidad Campesina de Corosha, Amazonas, Perú (2018) (n=15)
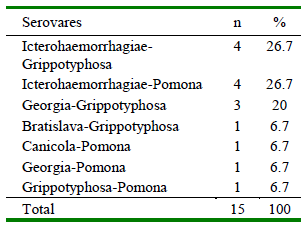
Cuadro 3. Características de la población de canes positiva a Leptospira spp en la Comunidad Campesina de Corosha Amazonas, Perú (2018) (n=55)
La mayoría de los canes presentó títulos de anticuerpos de 1:100 (punto de corte para animales positivos). Títulos de 1:200 fueron encontrados en individuos positivos a los serovares Grippotyphosa (n=3), Icterohaemorrhagiae (n=5), Pomona (n=1) y Bratislava (n=1), en tanto que solo tres (3) individuos presentaron anticuerpos contra los serovares evaluados, evidenciando coaglutinaciones de Grippotyphosa, Icterohaemorrhagiae, Pomona, Canicola, Bratislava y Georgia.
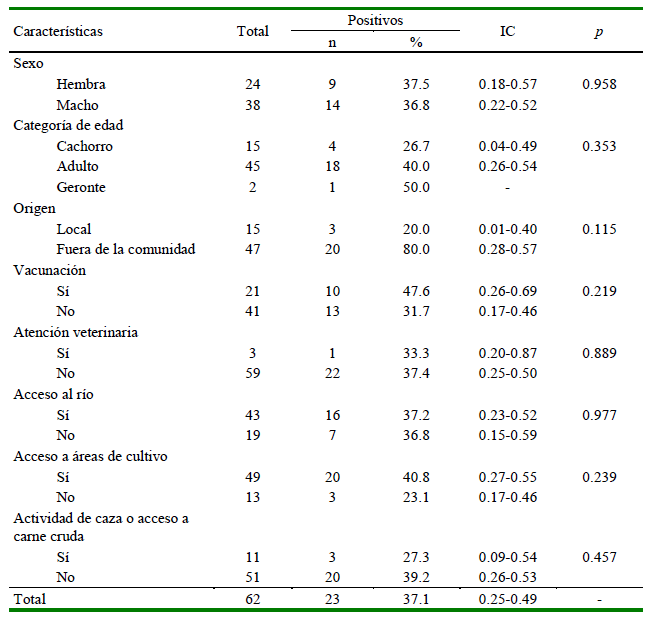
La seroprevalencia de T. gondii fue de 37.1% (23/62), encontrándose una ligera mayor prevalencia en hembras, adultos, animales con vacunación, sin atención veterinaria, con acceso al río y zonas de cultivo, y sin actividad de caza ni consumo de carne cruda; no obstante, ninguna de estas variables tuvo una asociación significativa (p> 0.05) (Cuadro 4).
Cuadro 4. Prevalencia de T. gondii según las características de la población de canes (n=62) en la Comunidad Campesina de Corosha Amazonas, Perú (2018)
Por último, de los 55 canes que se sometieron a ambas pruebas (Leptospira spp y T. gondii), 32.7% (18/55) resultó seropositivo a ambos microorganismos. De estos, 16.7% (3/18) eran cachorros, 77.8% (14/18) adultos y 5.6% (1/18) gerontes; además, 44.4% (8/18) era macho y la diferencia era hembra.
DISCUSIÓN
El estudio de agentes infecciosos con potencial zoonótico en canes es de interés para la salud pública y, en particular, en el contexto de comunidades rodeadas de bosques para la conservación de la fauna silvestre. En la comunidad campesina de Corosha predominó la tenencia de un solo perro por familia, principalmente individuos adultos y machos; similar a lo descrito por Ortega-Pacheco et al., 2017), donde la mayoría era macho (79/91) y de 1-6 años de edad (48/91), así como por dos Santos et al. (2017) con una población compuesta por canes de 1 a 3 años (299/576). La predominancia de tenencia de canes machos en el estudio se puede explicar debido a que estos suelen ser preferidos por la función de guardián que pueden cumplir (Curi et al., 2017; Ortega-Pacheco et al., 2017).
La prevalencia para Leptospira fue superior (82.3%) a la reportada en otros estudios, tales como en la región rural de Los Ríos, Chile, con 25.1% (Lelu et al., 2015), en la comunidad rural de Mayapam, México, con 45.2% (Ortega-Pacheco et al., 2017b), y en la zona rural de Petrolina, Brasil, con 5.6% (dos Santos et al., 2017). Los resultados sugieren que los canes estarían presentando una infección crónica que facilitaría la transmisión de Leptospira en la comunidad, dado que la bacteria permanece en los túbulos renales del hospedero sin presentar signos clínicos, pero con la capacidad de ser eliminada a través de la orina (Monahan et al., 2009). Además, condiciones ambientales como la temperatura y humedad serían favorables para la persistencia de las espiroquetas.
El estudio señala una mayor prevalencia en canes con acceso a fuentes de agua, como arroyos y riachuelos, donde se facilita la infección por Leptospira. El contagio de la bacteria se da por la ingestión de agua contaminada (Levett, 2001; Morgan et al., 2002), como se constató en el presente estudio. Los serovares predominantes fueron Grippotyphosa (58.3%), Icterohaemorrhagiae (54.6%) y Pomona (44.0%), similar a lo descrito por Ornellas et al (2020), donde el primero fue el más prevalente en su estudio en Rio de Janeiro. En contraste, difiere de lo reportado por Aguiar et al (2007) en canes urbanos donde estos serovares fueron los menos prevalentes. Por otro lado, Azócar-Aedo y Monti (2022) describen a los serovares Canicola y Pomona como los más recurrentemente reportados en canes domésticos de áreas urbanas y rurales en las regiones de Los Lagos y de Los Ríos en Chile.
La prevalencia de T. gondii fue alta (37.1%), aunque menor que la reportada por Ornellas et al. (2020) en canes de áreas rurales con 50% (15/30). La elevada prevalencia indica una alta contaminación ambiental por hospederos definitivos o reservorios (Ornellas et al., 2020). No se encontraron diferencias en la seropositividad a T. gondii y las variables evaluadas. Otros estudios, como el de Huertas-López et al. (2021) con canes de zonas urbanas y periurbanas no encontraron diferencias según raza, edad, sexo, ni entre esterilizados o castrados, pero sí una mayor frecuencia en individuos con acceso al exterior de las casas (outdoor). Además, es importante considerar la práctica de canes de caza en el bosque, lo cual favorecería la infección (Ornellas et al., 2020), aunque en este estudio no presentó significancia estadística.
Ninguno de los canes mostró signos clínicos de leptospirosis o toxoplasmosis. La toxoplasmosis en canes genera baja mortalidad y morbilidad, no suele ser la causa primaria de enfermedad y se asocia a la disminución de la respuesta inmunológica (Calero-Berna y Gennari, 2019). La ausencia de inmunidad podría predisponer a la presentación de signos clínicos relacionados con enfermedades neurológicas (Patitucci et al., 1997; Hoffmann et al., 2012); por lo que, los canes de la comunidad podrían tener riesgo de presentar este tipo de dolencias. Por otro lado, las vacunas contra leptospirosis canina confieren protección frente a los serovares Canicola e Icterohaemorrhagiae y, adicionalmente, incluyen otros serovares dependiendo de la zona geográfica. Su aplicación suele generar bajos títulos de anticuerpos (1:100 a 1:400) y además propicia reacción serológica a las pruebas diagnósticas (Azócar-Aedo, 2023), por lo que la ausencia de vacunación contra leptospirosis en los canes del estudio desestima la posibilidad de falsos positivos.
Además, hay que considerar que la prueba de hemaglutinación indirecta (HAI) para el diagnóstico de T. gondii tiene una buena sensibilidad, pero una especificidad baja, debido a reacciones cruzadas con otros agentes parasitarios (Blood y Radostits 1992). Sin embargo, el Toxotest presenta una sensibilidad clínica del 91.0% y especificidad de 96.4% (La Malfa et al., 2013) y ambas pruebas han mostrado una alta concordancia con un coeficiente de correlación de 0.86, por lo que las pruebas podrían sustituirse entre sí (Cerro et al., 2012; Gonzales et al., 2019).
CONCLUSIONES
El estudio demuestra la circulación de Leptospira spp y Toxoplasma gondii en la población de canes domésticos de la comunidad campesina de Corosha, con prevalencias de 83.3 y 37.1%, respectivamente.
Los serovares de Leptospira spp. predominantes en canes domésticos de la comunidad de Corosha fueron Grippotyphosa, Icterohaemorrhagae y Pomona.
No se encontraron asociaciones significativas con respecto a las características de manejo y prevalencia de los agentes, excepto en el caso de Leptospira, en el que los canes con acceso al río presentaron una mayor frecuencia de infección.












 uBio
uBio 


