INTRODUCCIÓN
Los modelos de predicción tienen como objetivo ayudar al personal asistencial en el proceso de toma de decisiones a partir de la identificación de pacientes con mayor riesgo de presentar un determinado desenlace 1. Las complicaciones posoperatorias ocurren en el 43% de los pacientes pediátricos sometidos a cirugía cardiaca con circulación extracorpórea 2 , 3. Las infecciones posoperatorias están asociadas a la cirugía cardiaca pediátrica, con una incidencia reportada del 11% al 38% 1 - 10. En este contexto, hay tres complicaciones infecciosas especialmente importantes: sepsis, mediastinitis y endocarditis, que, en su conjunto, forman una entidad llamada infección posoperatoria mayor (IPM), definida como una o más de las tres infecciones durante el periodo posoperatorio establecido desde las 48 horas posteriores a la operación hasta la fecha de alta. La incidencia de IPM a nivel mundial varía entre 2,8% y 3,5% en la población pediátrica y adulta 11 - 19. Aunque es poco frecuente, la IPM es una complicación muy severa debido al impacto en la mortalidad (22% a 25% en pacientes con IPM vs. 3% a 3,9% en pacientes sin IPM), en la duración de la estancia hospitalaria y en los costos institucionales 11 - 13 , 15 - 20.
Son varios los factores que se asocian con el desarrollo de IPM y la probabilidad es mayor en aquellos procedimientos asistidos por bypass cardiopulmonar o circulación extracorpórea (CEC) 1 , 12. Los factores preoperatorios asociados incluyen menor edad y peso, larga duración de la estancia hospitalaria previa, ingreso previo a una unidad de cuidados intensivos (UCI), mayor clase funcional de insuficiencia cardiaca, nivel más alto de complejidad de la cirugía [escala de ajuste de riesgo para cirugía cardiaca congénita (RACHS-1)], asistencia respiratoria, cardiopatía cianótica, desórdenes genéticos y otras comorbilidades 1 , 7 , 9 , 10 - 12 , 17 , 18. La IPM también se ha asociado con factores intraoperatorios como tiempo de cirugía prolongado y de CEC, el volumen y el número de transfusiones de sangre, hipotermia intraoperatoria, el uso de prótesis intracardiacas y la condición de tórax abierto al salir de la sala de operaciones (SOP) 1 , 7 , 10 , 17 , 18.
Se han propuesto diferentes modelos de predicción para calcular el riesgo de IPM después de la cirugía cardiaca. Entre los factores más relevantes se encontraron los siguientes: edad menor de seis meses, tiempo con el tórax abierto y estancia posoperatoria durante más de dos días 3. Existe un modelo predictivo de IPM de la Society of Thoracic Surgeons (STS) que incluye variables preoperatorias, comorbilidades y procedimientos quirúrgicos cardíacos 11; el modelo mostró buen rendimiento y una buena discriminación, y más tarde fue validado por Kansy en Polonia 12.
El objetivo de la investigación fue desarrollar un modelo de predicción de riesgo para IPM pediátricas y validar el de la STS.
MENSAJES CLAVE
Motivación para realizar el estudio: El impacto de las complicaciones posoperatorias a cirugías cardiacas, sobre todo sepsis, es muy importante en la mortalidad de los pacientes, la estancia hospitalaria y los costos asociados.
Principales hallazgos: Se desarrolló un modelo de predicción utilizando información preoperatoria para estimar el riesgo de infección posoperatoria mayor en pacientes pediátricos sometidos a cirugía cardiaca con circulación extracorpórea. El modelo validado internamente tuvo un buen rendimiento general.
Implicancias: Con este modelo predictivo de fácil uso se podrá identificar a los niños con alto riesgo de desarrollar una infección posoperatoria mayor a cirugía cardiaca pediátrica para desarrollar estrategias de prevención, protocolos sanitarios e investigaciones.
MATERIALES Y MÉTODOS
Tipo de estudio
Se realizó un estudio de cohorte retrospectivo. La población objetivo fueron todos los pacientes menores de 18 años que se sometieron a cirugía cardiaca con CEC admitidos entre 2000 y 2010 en la Unidad Post-Operatoria Cardiovascular (UPOCV) del Instituto Nacional de Salud del Niño (INSN) de Lima, Perú. Se excluyeron los pacientes que no usaron CEC.
El equipo de intensivistas de la UPOCV y un especialista en enfermedades infecciosas pediátricas del INSN realizaron el diagnóstico de infección. Se utilizaron los criterios diagnósticos y definiciones establecidos por la STS para sepsis, mediastinitis y endocarditis 21.
Procedimiento
Variables independientes
Se buscaron formalmente en la literatura los factores de riesgo de las infecciones posoperatorias cardiacas pediátricas 1 , 2 , 7 , 9 - 13 , 17 - 22. La búsqueda fue hecha en PubMed y Scopus hasta octubre de 2018. Las variables preoperatorias estudiadas incluyeron edad, peso, sexo, procedencia, prematuridad, desnutrición aguda, duración de la estancia preoperatoria, cirugía cardiaca previa, tipo de cardiopatía, puntuación de la escala de ajuste de riesgo para la cirugía cardiaca congénita (RACHS-1), ventilación mecánica previa, neumonía, tuberculosis pulmonar, traqueostomía, malformaciones congénitas, desórdenes genéticos, malformaciones cardiacas y no cardiacas, hepatitis, sepsis y endocarditis, insuficiencia renal, diálisis, choque cardiogénico, arritmias, hipertensión pulmonar, cardiopatía cianótica, clase funcional modificada por Ross, hipotiroidismo, antecedente de epilepsia y daño neurológico 7 , 11 - 13 , 17 , 21. Las variables intraoperatorias estudiadas fueron cirugía no electiva (frente a cirugía electiva), diagnóstico intraoperatorio, tipo de cirugía, tiempo de CEC, arresto circulatorio, ultrafiltración durante la CEC, uso de corticoesteroide, hipotermia profunda y tórax abierto.
Fuente de datos
Las fuentes de información fueron los registros médicos y la historia clínica del paciente. El conjunto de datos contenía la misma información indicada en la ficha de la STS para base de datos de cirugía cardiaca congénita. La recolección de datos fue realizada por uno de los investigadores (EWS). La información recopilada se exportó al programa SPSS versión 22 (IBM Corp., Armonk, NY, EUA) para su análisis estadístico.
Desarrollo del modelo
Se realizó una prueba de Chi cuadrado y la prueba exacta de Fisher para determinar las diferencias en la distribución de la población entre los pacientes con y sin IPM. Posteriormente, se realizó un modelo de regresión logística y binaria, y los que tuvieron un valor p < 0,200 fueron seleccionados 23. La asociación de cada variable con el resultado primario se reportó mediante odds ratio (OR) y un intervalo de confianza del 95% (IC 95%).
Validación interna del modelo de predicción
El modelo fue validado internamente usando la técnica de bootstrapping con 200 repeticiones. Cada repetición creó modelos en muestras de tamaño idéntico al tamaño de muestra del estudio, utilizando un muestreo aleatorio con reemplazo de individuos. La validación interna proporcionó un factor de corrección para ajustar los coeficientes del modelo, asumiendo que los coeficientes del modelo inicial estaban inflados para las predicciones en los nuevos grupos.
Evaluación del rendimiento del modelo
El modelo de predicción fue evaluado por discriminación y utilidad clínica. La discriminación se refiere a qué tan útil es el modelo para diferenciar entre pacientes con presencia y ausencia de IPM. La discriminación se cuantifica con el c-estadístico, que es equivalente al área bajo la curva ROC. El c-estadístico tiene valores que van de 0,5 a 1 y mientras más cerca está de 1, mejor es el modelo. Se evaluó la utilidad clínica con el análisis de beneficios 24; este método evalúa el beneficio de identificar correctamente a un paciente con alto riesgo de IPM (verdaderos positivos) frente a etiquetarlo erróneamente como probables IPM (falsos positivos) en un rango de umbrales razonables de riesgo de IPM donde el médico se siente cómodo para tomar una decisión (por ejemplo, administrar antibióticos para un IPM). Se consideró que un umbral del 20% puede ser razonable, con un rango de 5% a 40%.
Finalmente, se evaluó la calibración de un modelo validado internamente con un gráfico de calibración que describe la relación entre los riesgos previstos y observados de la IPM. Se utilizaron splines cúbicos restringidos para visualizar la relación. También se valoró la calibración del modelo usando la prueba de Hosmer-Lemeshow.
Puntaje y nomograma
Se presentó un modelo como puntuaciones para uso clínico. Se asignaron puntuaciones a cada variable, las cuales son proporcionales a la fuerza de asociación con el resultado primario de IPM. Por lo tanto, las variables del modelo final de predicción con OR más altas tuvieron puntuaciones más altas. El puntaje final fue dado por la suma de los puntajes de cada variable del modelo final. Las puntuaciones se crearon multiplicando el coeficiente β de la variable por 10. También se creó un nomograma, el cual permite el cálculo directo de la probabilidad del resultado primario. En el nomograma, cada variable tiene una escala diferente que es proporcional al peso de sus coeficientes 20 , 24 - 27. La equivalencia de puntajes y riesgos de IPM con variables preoperatorias también fue calculado. Todos estos análisis se realizaron con el programa R 3.3.2 (www.r-project.org).
Validación del modelo de la STS
Finalmente, otra forma de validar el modelo, además de la discriminación y calibración interna, fue la comparación de las tasas de infección. Se comparó el presente modelo y el de la STS usando las tasas de IPM de seis cirugías cardiacas comparables con el presente estudio (comunicación interauricular, comunicación interventricular, canal atrio ventricular, tetralogía de Fallot, Glenn, y doble salida del ventrículo derecho) a través de la prueba exacta de Fisher.
RESULTADOS
Características demográficas
Se analizó un total de 1025 pacientes, de los cuales 59 (5,8%) tuvieron al menos un episodio de IPM (4,8% sepsis, 1,0% mediastinitis, 0% endocarditis). Tres pacientes tuvieron más de un tipo de infección. El 95% de los pacientes operados tuvieron sepsis posoperatoria. Hubo sólo diez casos de mediastinitis.
Los pacientes con IPM fueron más jóvenes (2,95 vs. 5,42 años; p < 0,001), y el 62,7% fueron hombres (Tabla 1). El peso promedio de los pacientes con IPM fue significativamente menor que el resto de los pacientes (10,9 kg frente a 16,8 kg; p < 0,001) (Tabla 2). La duración de la estancia preoperatoria fue mayor en los pacientes con IPM (mediana de 40 vs. 15 días; p < 0,001). La mayoría de los pacientes con IPM tenía un diagnóstico de cardiopatía cianótica (69,5%; p < 0,001). Además, los pacientes con IPM tuvieron un mayor porcentaje en la escala 3-4 de RACHS-1 (54% vs. 27%; p < 0,001). Un resultado similar fue para la clase funcional IV modificada por Ross (mayor en pacientes con IPM, 37% frente a 15% en la población total, p < 0,001). Por otro lado, más pacientes con IPM tuvieron ventilación mecánica previa (11,9% vs 0, 9%; p < 0,001). Hubo un mayor número de pacientes con antecedentes de infección previa ya resuelta al momento de la cirugía en los casos con IPM (7,5% vs 32%; p < 0,001). No hubo diferencias en cuanto a las anomalías congénitas, malformaciones y el estado de desnutrición.
Tabla 1 Características clínicas demográficas de los pacientes pediátricos con cirugía cardiaca con circulación extracorpórea en el Instituto Nacional de Salud del Niño, entre 2000 y 2010
| Variables | Total | Sí (n = 59) | No (n = 966) | Valor de p | OR (IC 95%) | Valor de p |
|---|---|---|---|---|---|---|
| Edad (años) (media, DE) | 5,27 (4,8) | 2,95 (4,6) | 5,42 (4,8) | <0,001 | 0,86 (0,79-0,93) | <0,001 |
| Grupo edad | ||||||
| 0-6 m | 120 (11,7) | 28 (47,5) | 92 (9,5) | <0,001 | Ref. | |
| 7-11 m | 54 (5,3) | 5 (8,5) | 49 (5,1) | 7,30 (3,20-16,65) | 0,010 | |
| 12 m - 5 a | 502 (49) | 17 (28,8) | 485 (50,2) | 2,45 (0,77-7,82) | 0,130 | |
| 6-9 a | 149 (14,5) | 1 (1,7) | 148 (15,3) | 0,84 (0,36-1,98) | 0,690 | |
| 10 años a más | 200 (19,5) | 8 (13,6) | 192 (19,9) | 0,16 (0,02-1,31) | 0,090 | |
| Sexo (n, %) | ||||||
| Hombre | 523 (51,0) | 37 (62,7) | 486 (50,3) | 0,040 | 1,66 (0,96-2,86) | 0,067 |
| Mujer | 502 (49,0) | 22 (37,3) | 480 (49,7) | Ref. | ||
| Procedencia (n, %) | ||||||
| Lima | 533 (52,0) | 33 (55,9) | 500 (51,8) | 0,310 | 0,85 (0,49-1,43) | 0,530 |
| Provincias | 492 (48,0) | 26 (44,1) | 466 (48,2) | Ref. | ||
| Años de cirugía (n, %) | ||||||
| 2001-2005 | 439 (42,8) | 20 (33,9) | 419 (43,4) | 0,176 | 0,67 (0,39-1,17) | 0,160 |
| 2006-2010 | 586 (57,2) | 39 (66,1) | 547 (56,6) | Ref. | ||
| Prematuridad (n, %) | ||||||
| No | 1013 (98,8) | 58 (98,3) | 955 (98,9) | 0,093 | 1,50 (0,19-11,79)* | 0,700 |
| 32-35 semanas | 9 (0,9) | 0 (0,0) | 9 (0,9) | |||
| 36 semanas | 3 (0,3) | 1 (1,7) | 2 (0,2) |
* Comparado con prematuridad.
OR: odds ratio; DE: desviación estándar; m: meses; a: años, Ref.: referencia.
Tabla 2 Características clínicas preoperatorias e intraoperatorias de los pacientes pediátricos con cirugía cardiaca con circulación extracorpórea en el Instituto
| Variables | Total | Sí (n = 59) | No (n = 966) | Valor de p | OR (IC 95%) | Valor de p |
|---|---|---|---|---|---|---|
| Preoperatorias | ||||||
| Peso, kg (promedio, DE) | 16,50 (12,3) | 10,9 (12,5) | 16,8 (12,3) | <0,001 | 0,94 (0,91-0,97) | 0,001 |
| Grupo peso (kg) | ||||||
| 2,5-5 | 150 (14,6) | 30 (50,8) | 120 (12,4) | <0,001 | Ref. | |
| 6-10 | 279 (27,2) | 13 (22,0) | 266 (27,5) | 5,79(2,33-14,38) | 0,001 | |
| 11-30 | 451 (44,0) | 10 (16,9) | 441 (45,7) | 1,13(0,42-3,04) | 0,810 | |
| 31 a más | 145 (14,1) | 6 (10,2) | 139 (14,4) | 0,53(0,19-1,47) | 0,220 | |
| Estancia preoperatoria, días (mediana, RIC) * | 4 (14) | 15 (40) | 4 (12,25) | <0,001 | 1,08 (1,04-1,11) | <0,001 |
| Grupo estancia previa (días) | ||||||
| 0-1 | 302 (29,5) | 11 (18,6) | 291 (30,1) | <0,001 | Ref. | |
| 2-7 | 347 (33,9) | 13 (22,0) | 334 (34,6) | 0,29(0,14-0,59) | 0,001 | |
| 8-14 | 116 (11,3) | 5 (8,5) | 111 (11,5) | 0,30(0,15-0,58) | 0,001 | |
| 15 a más | 260 (25,4) | 30 (50,8) | 230 (23,8) | 0,35(0,13-0,91) | 0,320 | |
| Tipo de cardiopatía (n, %) | ||||||
| CIV | 329 (32,1) | 7 (11,9) | 322 (33,3) | <0,001 | Ref. | |
| TF | 152 (14,8) | 9 (15,3) | 143 (14,8) | 2,895 (1,06-7,93) | ||
| CIA | 123 (12,0) | 2 (3,4) | 121 (12,5) | 0,760 (0,16-3,71) | ||
| DVAPT | 77 (7,5) | 10 (16,9) | 67 (6,9) | 6,866 (2,52-18,68) | <0,001 | |
| Otras | 344 (33,6) | 31 (52,5) | 313 (32,4) | 4,556 (1,98-10,49) | <0,001 | |
| Cardiopatía cianótica (n, %) | 420 (41,0) | 41 (69,5) | 379 (39,2) | <0,001 | 3,53 (1,99-6,23) | <0,001 |
| RACHS-1 (n, %) | ||||||
| 1 | 128 (12,5) | 2 (3,4) | 126 (13,0) | <0,001 | 0,107 (0,02-0,53) | 0,001 |
| 2 | 617 (60,2) | 25 (42,4) | 592 (61,3) | 0,284 (0,12-0,69) | 0,060 | |
| 3 | 226 (22,0) | 25 (42,4) | 201 (20,8) | 0,835 (0,34-2,05) | 0,690 | |
| 4 | 54 (5,3) | 7 (11,9) | 47 (4,9) | Ref. | ||
| RACHS-1 (mediana, RIC) * | 2 (2,3) | 3 (2,3) | 2 (2,3) | <0,001 | 2,20 (1,57-3,08) | <0,001 |
| Clase funcional modificada Ross (n, %) | ||||||
| I | 216 (21,1) | 5 (8,5) | 211 (21,8) | <0,001 | 0,142 (0,05-0,38) | <0,001 |
| II | 280 (27,3) | 16 (27,1) | 264 (27,3) | 0,364 (0,19-0,72) | 0,030 | |
| III | 375 (36,6) | 16 (27,1) | 359 (37,2) | 0,267 (0,14-0,53) | <0,001 | |
| IV | 154 (15,0) | 22 (37,3) | 132 (13,7) | Ref. | ||
| Clase funcional modificada Ross IV (n, %) | ||||||
| Sí | 154 (15,0) | 22 (37,29) | 132 (13,66) | <0,001 | 3,76 (2,15-6,57) | <0,001 |
| No | 871 (85,0) | 37 (62,71) | 834 (86,34) | Ref. | ||
| Malformación congénita (n, %) | 83 (8,1) | 7 (11,9) | 76 (7,9) | 0,190 | 1,576 (0,69-3,59) | 0,280 |
| Desorden genético (n, %) | 171 (16,7) | 7 (11,9) | 164 (17,0) | 0,200 | 1,519 (0,68-3,4) | 0,310 |
| Cirugía cardiaca previa (n, %) | 225 (22,0) | 13 (22,0) | 212 (21,9) | 0,550 | 1,005 (0,53-1,89) | 0,980 |
| Desnutrición aguda (n, %) | 492 (48,0) | 30 (50,8) | 462 (47,8) | 0,370 | 1,129 (0,67-1,91) | 0,650 |
| Ventilación mecánica (n, %) | 16 (1,6) | 7 (11,9) | 9 (0,9) | <0,001 | 0,07 (0,03-0,19) | <0,001 |
| Infección previa (n, %) | 91 (8,9) | 19 (32) | 72 (7,5) | <0,001 | 5,90 (3,25-10,71) | <0,001 |
| Traqueotomía (n, %) | 1 (0,1) | 0 (0) | 1 (0,1) | 0,940 | - | - |
| Insuficiencia renal (n, %) | 6 (0,6) | 0 (0) | 6 (0,6) | 0,700 | - | - |
| Intraoperatorias | ||||||
| Diagnóstico Intraoperatorio (n, %) | ||||||
| CIV | 321 (31,3) | 7 (11,9) | 314 (32,5) | <0,001 | Ref. | |
| TF | 146 (14,2) | 6 (10,2) | 140 (14,5) | 1,92 (0,64-5,82) | 0,250 | |
| CIA | 115 (11,2) | 2 (3,4) | 113 (11,7) | 0,79 (0,16-3,88) | 0,780 | |
| DVAPT | 76 (7,4) | 10 (16,9) | 66 (6,8) | 6,79 (2,49-18,51) | <0,001 | |
| Otras | 367 (35,8) | 34 (57,6) | 333 (34,5) | 4,58 (2-10,48) | <0,001 | |
| Cirugía no electiva ⱡ (n, %) | 480 (46,8) | 47 (79,7) | 433 (44,8) | <0,001 | 4,821 (2,53-9,2) | <0,001 |
| Cirugía cardiaca paliativa (n, %) | 204 (19,9) | 12 (20,3) | 192 (19,9) | 0,520 | 1,029 (0,54-1,98) | 0,930 |
| Tiempo CEC, minutos (media, DS) | 93,23 (62,6) | 97,1 (50) | 92,9 (63,3) | 0,570 | 1,01 (0,99-1,01) | 0,630 |
| Arresto circulatorio (n, %) | 23 (2,2) | 3 (5,1) | 20 (2,1) | 0,140 | 0,39 (0,11-1,37) | 0,140 |
| Ultrafiltración durante CEC (n, %) | 467 (45,6) | 30 (50,8) | 437 (45,2) | 0,240 | 1,25 (0,74-2,12) | 0,400 |
| Uso corticoide (n, %) | 845 (82,4) | 48 (81,4) | 797 (82,5) | 0,900 | 0,9 (0,46-1,76) | 0,760 |
*Por incremento en 1 unidad. ⱡ vs. electiva.
CIV: comunicación interventricular; TF: tetralogía de Fallot; CIA: comunicación interauricular; DVAPT: drenaje venoso anómalo pulmonar total; RACHS-1: clasificación ajustada al riesgo para la cirugía cardiaca congénita; DE: desviación estándar; RIC: rango intercuartil; OR: odds ratio; Ref.: referencia
Se encontró que los pacientes sometidos a cirugías no electivas presentaron mayor IPM (79,7% vs 44,8%; p < 0,001) (Tabla 2). No hubo diferencia entre los casos de IPM para el año de cirugía, el mayor tiempo de circulación extracorpórea, hipotermia profunda, tórax abierto y prótesis valvular.
La tasa de mortalidad total a 30 días fue de 13,7% y significativamente mayor en el grupo de pacientes con IPM (mortalidad 37/59 [63%] vs. 125/966 [13%]; p < 0,001). La duración de ventilación mecánica posoperatoria (301,6 horas vs. 34,3 horas; p < 0,001), la estancia en la unidad de cuidados intensivos posoperatoria (20,9 días frente a 5,1 días; p < 0,001) y la estancia posoperatoria (42,2 días frente a 15,1 días; p < 0,001) fue mayor en pacientes con IPM. Nueve fallecidos con IPM tenían antecedente de sepsis y dos de endocarditis. Excluyendo a estos pacientes, la mortalidad en pacientes con IPM siguió siendo alta (58%) y significativamente diferente de los pacientes sin IPM (p < 0,001). De los 32 reintervenidos, dos fallecieron de sepsis.
Modelo de regresión bivariado y multivariado
En el análisis bivariado de las variables preoperatorias, se encontró una fuerte asociación entre el IPM y menor edad, menor peso, mayor estancia preoperatoria, tipo de cardiopatía, cardiopatía cianótica, mayor escala RACHS-1 y de clase funcional modificada por Ross, y ventilación mecánica previa (Tabla 1 y 2). La condición quirúrgica no electiva (vs. electiva) también tuvo una asociación estadísticamente con IPM (Tabla 2).
Se creó un modelo preoperatorio y un modelo combinado preoperatorio e intraoperatorio. En el primer modelo, mostrado en la Tabla 3, las variables asociadas con IPM fueron estancia hospitalaria preoperatoria prolongada (p = 0,053), diagnóstico de enfermedad cardiaca cianótica (p = 0,020), RACHS-1 (p = 0,013) y clase funcional IV modificada por Ross (p = 0,009). En el segundo modelo, las variables asociadas fueron cardiopatía cianótica (p = 0,020), RACHS-1 (p = 0,020), clase funcional IV modificada por Ross (p = 0,010) y condición quirúrgica no electiva (p = 0,020).
Tabla 3 Análisis multivariado preoperatorio
| Variables | β | OR (IC 95%) | Valor de p |
|---|---|---|---|
| Edad, por incremento en 1 año | -0,184 | 0,83 (0,68-1,02) | 0,070 |
| Sexo masculino | 0,317 | 1,38 (0,77-2,50) | 0,280 |
| Peso, por kg | 0,040 | 1,04 (0,96-1,12) | 0,310 |
| Estancia preoperatoria, por incremento en 1 día | 0,002 | 1,06 (1,02-1,11) | 0,053 |
| Cardiopatía cianótica | 0,800 | 2,23 (1,17-4,26) | 0,020 |
| RACHS-1, por incremento en 1 unidad | 0,480 | 1,62 (1,09-2,40) | 0,013 |
| Clase funcional IV de Ross | 0,905 | 2,56 (1,30-5,00) | 0,009 |
| Ventilación mecánica preoperatoria | 0,556 | 1,91 (0,60-6,06) | 0,270 |
IC 95%: intervalo de confianza al 95%; RACHS-1: clasificación ajustada al riesgo para la cirugía cardiaca congénita; OR: odds ratio.
Desempeño del modelo preoperatorio
La validación interna del modelo resultó en un factor de contracción de 0,84. La discriminación del modelo fue buena, con un c-estadístico ajustado de 0,80 (IC 95%: 0,74-0,86). El modelo combinado preoperatorio e intraoperatorio no mostró una mejoría significativa en la discriminación en comparación con el modelo preoperatorio (p = 0,600), que se muestra en el material suplementario (Figura S1). El análisis del beneficio neto demostró que ambos modelos eran similares para el IPM oscilando entre el 0% y el 40%, y que ambos modelos son mejores que no usar un modelo de predicción (material suplementario, Figura S2). La calibración de ambos modelos fue buena como se esperaba en un modelo validado internamente.
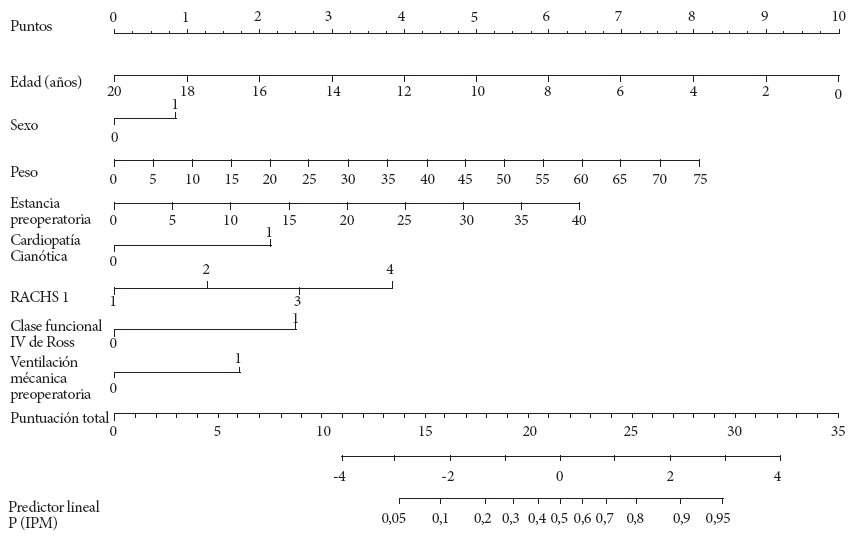
Se presentó el modelo preoperatorio como puntuaciones y un nomograma. Los puntajes por variable incluidos en el modelo final se muestran en la Tabla 4, y la equivalencia de puntajes y riesgos de IPM se muestran en la Tabla 5. Los puntajes entre 12 y 29 corresponden a probabilidades de IPM del 5% al 95%, respectivamente. En la Figura 1, se muestra un nomograma. Por ejemplo, una niña de 5 años con 20 kg, 30 días de estadía preoperatoria, con cardiopatía cianótica y una escala RACHS-1 de 3 tendrá 19 puntos y 30% de riesgo de IPM.
Tabla 4 Puntuaciones para el riesgo de infecciones posoperatorias mayores a cirugía cardiaca pediátrica por variable incluida en el modelo multivariado preoperatorio
| Variable | Valor | Puntuación |
|---|---|---|
| Edad | Por año de edad | -2 |
| Sexo masculino | Sí | 3 |
| Peso | Por 2 kg | 1 |
| Duración de la estancia preoperatoria, días | 5 | 1 |
| 10 | 2 | |
| 15 | 4 | |
| 20 | 5 | |
| 25 | 6 | |
| 30 | 8 | |
| 35 | 9 | |
| 40 | 10 | |
| Cardiopatía cianótica | Sí | 8 |
| RACHS-1 | Por unidad | 5 |
| Clase funcional IV | Sí | 9 |
| Ventilación mecánica preoperatoria | Sí | 6 |
*Nota: La estancia preoperatoria se divide por 5 para expresar el riesgo por aumento de 5 días en la estadía en el hospital. Por ejemplo: un paciente con 25 días de hospitalización antes de la cirugía tiene un valor de 5 (es decir, 25 sobre 5) y tiene 1 punto según el modelo.
RACHS-1: clasificación ajustada al riesgo para la cirugía cardiaca congénita.
Tabla 5 Riesgo de infecciones posoperatorias mayores a cirugía cardiaca pediátrica según la puntuación del modelo preoperatorio
| Puntuación | Riesgo de IPM (%) |
|---|---|
| 14 | 5 |
| 16 | 10 |
| 18 | 20 |
| 19 | 30 |
| 21 | 40 |
| 22 | 50 |
| 23 | 60 |
| 24 | 70 |
| 25 | 80 |
| 27 | 90 |
| 29 | 95 |
IPM: infecciones posoperatorias mayores a cirugía cardiaca pediátrica
Validación del modelo de la Society of Thoracic Surgeons
Se validó el modelo de la STS para IPM con nuestra misma base de datos. La discriminación fue moderada (c-estadístico de 0,78; IC 95%: 0,71 a 0,84) y la calibración no fue buena (la prueba de Hosmer-Lemeshow fue 18,2; p = 0,020). El modelo STS subestimó el riesgo de IPM, en particular en los altos riesgos observados en nuestra población. Se realizó una prueba exacta de Fisher para comparar ambos modelos en cuanto a tasa de IPM (material suplementario, Tabla S1). Se hallaron diferencias significativas en dos cirugías: comunicación interauricular y doble salida del ventrículo derecho (p = 0,010 y p = 0,030, respectivamente).
DISCUSIÓN
Se desarrolló un modelo de riesgo para IPM con buen desempeño. Se utilizó la información clínica de todas las cirugías cardiacas pediátricas bajo circulación extracorpórea realizadas en una década en un instituto de referencia nacional de atención de salud pediátrica en Perú. Asimismo, adicional al modelo predictivo que establece un puntaje para estimar el pronóstico clínico, se elaboró un nomograma para su uso simplificado. Se encontró una tasa de IPM de 5,8% (sepsis 4,8%), y se identificaron algunos factores de riesgo preoperatorios, todos ellos fáciles de medir.
La incidencia de infección posoperatoria y los factores de riesgo para las infecciones en la población estudiada son similares a los encontrados en países de altos ingresos, así como en los de bajos de ingresos 7 , 11 - 22. El estudio confirma que la IPM está asociada a una mortalidad significativamente alta, una larga duración de ventilación mecánica, y una prolongada estancia posoperatoria, así como en la UCI. A pesar de las tasas de IPM similares, la tasa de mortalidad encontrada fue mayor en comparación con las tasas descritas en estudios anteriores 11 - 12 , 17 , 20 , 22. Es de destacar que los estudios anteriores excluyeron a los pacientes con antecedentes de sepsis o endocarditis para calcular las tasas de mortalidad en IPM. Aun excluyendo los siete pacientes con antecedentes de sepsis y dos con endocarditis, la tasa es alta (58%) y significativamente diferente de aquellos sin IPM. Se necesitan más estudios para comprender mejor los factores relacionados con las consecuencias a corto y largo plazo de las infecciones posoperatorias cardiacas en pacientes pediátricos, y si las intervenciones en un periodo de seguimiento podrían cambiar los desenlaces.
No hubo cambios importantes en la tasa de infección posoperatoria principal en el periodo de diez años. Tampoco hubo grandes cambios en la práctica médica durante el periodo de estudio con respecto a los cirujanos, el personal de sala de operaciones (SOP), UPOCV, las técnicas de lavado de manos, el uso de antibióticos, el cuidado de heridas o la complejidad de los procedimientos; todos los anteriores regidos por protocolos aprobados por diversos comités internacionales y empleados en el INSN 28 , 29.
Se confirmó que ser menor edad, tener menor peso, mayor duración de la estancia preoperatoria, mayor complejidad del procedimiento (RACHS-1), diagnóstico de cardiopatía cianótica, ventilación mecánica preoperatoria y condición quirúrgica no electiva son variables asociadas con un mayor riesgo de IPM 2 , 7 , 9 , 10 - 12 , 17 , 18. Además, se identificaron otros factores de riesgo para la IPM, como clase funcional IV modificada por Ross con una alta asociación. No hubo pacientes con diagnóstico de Di George y los casos con síndrome Down no mostraron diferencia para IPM.
Las investigaciones anteriores también describieron factores intraoperatorios asociados con un mayor riesgo de IPM, como mayor tiempo de CEC, hipotermia profunda, tórax abierto al salir de la SOP y el uso de prótesis valvular durante la cirugía; las cuales, no fueron significativas en el presente análisis 2 , 7 , 10 , 17 , 18.
Usando predictores bien establecidos, este modelo identificó con precisión a los pacientes con alto riesgo de IPM. Mostró una calibración satisfactoria, así como una buena discriminación. Se validó el modelo de la STS presentado por Barker et al. 11 con los datos de diez años y se encontró un c-estadístico similar de 0,78 y una calibración de 0,66 la cual difiere de la de este estudio; dicho modelo presentó un conjunto de variables preoperatorias similar al presente; sin embargo, los autores encontraron que la cirugía cardiaca previa y anomalías genéticas eran factores de riesgo para IPM.
Se realizó además una comparación con el estudio de Kansy et al. 12, siendo este último ligeramente mejor en cuanto a discriminación con un c-estadístico de 0,81 y una calibración de 0,2. Ambos modelos incluyen variables como edad, RACH-1, estancia previa y ventilación preoperatoria; pero el presente modelo también incluye hombres, peso, clase funcional modificada por Ross y cardiopatía cianótica. Sin embargo, las características de la población diferían de la estudiada en menor edad al momento de la cirugía (2,4 vs. 5,7 años) y menor número de niños con el percentil peso para de edad-sexo <5% (35,2% vs. 63,8%). Los niños con CEC fueron 80% en comparación con el 100% de la población estudiada. La incidencia de sepsis y mediastinitis fue menor que en este estudio, y además no hubo casos de endocarditis. Por otro lado, no incluyeron niños con infecciones previas.
Sen et al. ( 30 evaluaron la sepsis bacteriana e infección en el sitio quirúrgico, como mediastinitis, y encontraron que los factores de riesgo de infección fueron edad más temprana al momento de la cirugía, mayor complejidad quirúrgica, menor saturación de oxígeno y demás comorbilidades; la incidencia de sepsis fue del 5,5% y más de la mitad de los casos tenían desnutrición, datos similares a los presentados en este estudio. No incluyeron niños con infecciones previas, cirugía cardiaca previa y ventilación mecánica; y no analizaron el tiempo de estadía preoperatoria. El presente modelo incluye variables similares a las de ellos, como edad, RACH-1 y condición cianótica.
Las herramientas de puntaje y nomograma creados en este estudio se pueden aplicar fácilmente en el entorno clínico, lo cual constituye una fortaleza del estudio. Asimismo, ambas herramientas se desarrollaron teniendo en cuenta las características demográficas específicas de la población estudiada, lo que permite extrapolar los hallazgos a circunstancias similares que tienen lugar en América del Sur y otros países en desarrollo. Sin embargo, el estudio no es esquivo de limitaciones. Primero, el número de pacientes con IPM era relativamente pequeño y pertenecía a un solo centro de atención médica en un entorno específico. En segundo lugar, el análisis y el modelo no incluyeron datos como el patógeno causante específico y el uso de antibióticos profilácticos preoperatorios, el estado socioeconómico como el acceso a la atención médica, el nivel educativo y el ingreso familiar. En tercer lugar, una vez comparada la calibración de este modelo con el modelo de la STS (0,02 vs. 0,66; p > 0,050) se demuestra que el modelo no ajusta bien, ya que lo observado difiere de lo esperado, por lo cual se requieren estudios multicéntricos para obtener una herramienta más precisa.
En conclusión, se desarrolló un modelo de predicción de infección posoperatoria con adecuada discriminación y buen desempeño, el cual puede usarse como una de las estrategias de control de calidad y herramienta de comparación con otros centros de cirugía cardiaca pediátrica para la mejor toma de decisiones gerenciales. Se validó también el modelo propuesto por la STS con buena discriminación.











 texto en
texto en