Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.10 n.2 Lima jul./dic. 2003
Caracterización limnológica de la laguna de Cashibococha (Ucayali-Perú) durante el año 2001*
Limnological characteristics of the Amazonic Cashibococha Lake (Ucayali-Peru) at 2001
José Riofrío 1, Iris Samanez 2, Fredi Carrasco 3 y Mirella Clavo 4
1 Instituto de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas, UNMSM.
2 Laboratorio de Limnología - Museo de Historia Natural. UNMSM.
3 Laboratorio NATURA - Pucallpa.
4 Instituto Veterinario de Investigaciones Tropicales y de Altura (IVITA), Facultad de Medicina Veterinaria. UNMSM.
Presentado: 18/08/2003
Aceptado: 19/11/2003
Resumen
Durante el año 2001 se realizaron muestreos bimensuales en tres estaciones fijas en la laguna de Cashibococha (Ucayali, Perú). Cashibococha presenta aguas de color verdoso a café oscuro, con pH entre 6 a 6,8, Conductividad entre 10 y 30mS.cm -1, Transparencia de 21 a 59 cm y Alcalinidad Total entre 14 y 22 mg CaCO3 / L . La temperatura superficial del agua osciló entre 24,4 y 37 ºC y el Oxígeno Disuelto entre 1,3 y 7,4 mg/ L. Los análisis bacteriológicos registraron recuentos de aerobios mesófilos entre 350 y 3600 UFC/ mL. Los coliformes totales oscilaron entre 3 y 43 NMP/ 100 mL. Se diferenciaron 47 especies pertenecientes a 20 familias de macrófitas acuáticas; el mayor número de especies se reportó durante la época de Transición - Creciente (octubre - noviembre), debido a la inundación del bosque. Fueron identificadas 52 especies de fitoplancton, la División Chlorophyta fue la mas dominante. La comunidad fitoplanctónica está dominada por las especies Actinastrum hantzschi, Spirogyra sp., Eudorina elegans, Pandorina morum y Closterium kuetzingui. Se diferenciaron 54 especies de Zooplancton. Los rotíferos fue el taxa dominante. La densidad de zooplancton está dominada por Brachionus patulus macracanthus y Polyarthra vulgaris. Fueron identificadas 66 especies de peces, pertenecientes a 55 géneros, 11 familias y 4 órdenes. El orden dominante en diversidad y abundancia fue el de Characiformes, Curimata vittata fue la especie dominante en la comunidad de peces en éstas áreas litorales. Los índices de diversidad fueron superiores a 3,0 bits. ind-1, en todas las estaciones y lugares de muestreo. De igual manera los valores de equitabilidad fueron superiores a 0,8 en todas las estaciones y lugares de muestreo.
Palabras clave: Cashibococha, Ucayali, lagos amazónicos, plancton, peces amazónicos
Abstract
Cashibococha lagoon was studied during 2001 year. Three stations were bimonthly sampling. Cashibococha have greenish to brownish colour water, pH between 6 to 6,8, Conductivity 10 to 30 mS.cm-1, Transparency 21 to 59 cm and Total Alkalinity 14 to 22 mg CaCO3 / L. Surface temperature were between 24,4 and 37° C and Dissolved Oxygen 1,3 and 7,4 mg / L. Bacteriological analysis report 350 to 3600 CFU / mL for mesophilic aerobic bacteria and 3 to 43 NMP / 100 mL for total Coliforms. A total of 47 species of Freshwater Macrophytes were recorded and mayor diversity was associated with inundation of the forest period (octubre - noviembre). A total of 52 phytoplankton species were found, Chlorophyta Division was the dominant and Actinastrum hantzschi, Spirogyra sp., Eudorina elegans, Pandorina morum y Closterium kuetzingui were the principal species. In zooplankton community was recorded 54 species and the taxa dominant was Rotifera with Brachionus patulus macracanthus and Polyarthra vulgaris as principal species. Characiforms fishes was dominant and Curimata vittata the principal specie. Shannon-Wiener diversity index were highest to 3,0 bits. ind-1 in all places and times of sampling.
Keywords: Cashibococha, Ucayali, Amazonian lakes, plankton, Amazonian fishes.
Introducción
La Amazonia peruana cuenta con innumerables ambientes acuáticos de los cuales los sistemas lénticos o "cochas", en la selva baja, son los que tienen una función importante tanto para en la pesquería como en la dinámica de las poblaciones acuáticas. El origen de estas cochas puede ser meándrico, con una característica forma en U o J, como en el caso de Yarinacocha, o tectónico con forma dendrítica, como en el caso de Cashibococha. La laguna de Cashibococha se ubica en el Departamento de Ucayali, la Provincia Coronel Portillo, Distrito de Yarinacocha, entre los meridianos 74º 40h 42min 51,2seg y 74º 36h 25min 42,7seg y los paralelos 8º 14h 59min 59,7seg y 8º 23h 34min 16,7seg. tiene un área de 453 ha, con largos de 6500 m y anchos que varían de 80 a 350 m, perímetro de 26 km. Dentro del sistema de captación de agua pluvial, posee una cuenca de 27,261 ha. Toda esta agua al llegar a la laguna sale por un solo caño denominado Caño de Cashibo, que desemboca en la laguna de Yarinacocha (Pimentel y Rengifo, 1997). Samanéz (1996) reporta alta diversidad de especies en la laguna de Cashibococha, tanto de plancton, peces y macrófitas, advirtiendo sobre la paulatina deforestación ribereña y el uso de herbicidas que atentarían contra la diversidad biológica del ecosistema e incluso la salud de sus pobladores, por sus efectos secundarios. Chocano (2002), analiza especímenes de la colección de peces del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (MHN-UNMSM) colectados entre 1971 y 2001 en Cashibococha, reportando para la laguna 122 especies. En el presente trabajo se reportan los resultados del estudio llevado a cabo durante el 2001 en la laguna de Cashibococha donde fueron determinadas las características físico químicas de la laguna, características bacteriológicas, la composición del fitoplancton, zooplancton y peces en tres estaciones fijas de muestreo en tres épocas del año.
Material y métodos
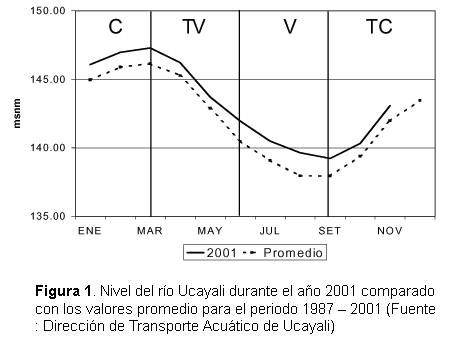
Se establecieron tres estaciones fijas en la laguna de Cashibococha: Misión Suiza (08º 21' 12,3'' LS y 74º 39' 37,3'' LO), Fundo Nilton (08º 21' 21,3'' LS y 74º 39' 34'' LO) y Puerto de Cashibococha (08º 20' 4,7'' LS y 74º 39' 3,2''LO), programándose dos muestreos, por estación fija, por época del año. Las épocas fueron definidas de acuerdo al nivel del río Ucayali (Fig. 1) como: C = Creciente (enero-marzo); TV = Transición-Vaciante (abril-junio); V = Vaciante (julio-setiembre) y TC = Transición-Creciente (octubre-diciembre). No fue posible realizar los trabajos durante la creciente (enero-marzo) por la inaccesibilidad a la laguna en esta época del año.
Los muestreos se realizaron entre las 8 y 14 hr. En cada estación se colectó la siguiente información: Temperatura superficial del agua (ºC), pH (unidades), Transparencia Secchi (cm), Conductividad (mS.cm-1), Alcalinidad Total (mg CaCO3 / L), Oxígeno Disuelto (mg / L), Temperatura ambiente (ºC), Nubosidad (octavos).
Se colectó muestras de agua para los análisis bacteriológicos usándose frascos esterilizados y preservándose la muestra en refrigeración para su traslado al laboratorio NATURA-Pucallpa donde se realizaron los recuentos de aerobios mesófilos, coliformes totales y coliformes fecales, de acuerdo a la metodología descrita en APHA (1989).
El plancton fue colectado por filtrado de 100 L de agua a través de una red cónica de 25m de abertura de malla. Las muestras fueron preservadas en formol al 4% y analizadas posteriormente cualitativa y cuantitativamente en el laboratorio de Limnología del MHN-UNMSM. Los datos fueron procesados en individuos . mL -1 por época del año y estación de muestreo. Para las identificaciones se emplearon los trabajos de Prescott (1975), Samanéz (1979, 1988) y Samanéz y Zambrano (1995). Las macrófitas fueron identificadas in situ, realizándose la colecta de especies dudosas para su identificación en el laboratorio de IVITA-Pucallpa, siguiendo a Brakco y Zarucchi (1993) y Kann et al. (1993). Los peces fueron colectados con red chinchorro de 10 x 1,5 m y 30 x 1,5 m y 0,5 cm de abertura de malla, a una distancia de la orilla entre 10 y 15 m, dependiendo de la época del año. Los ejemplares capturados se preservaron en solución de formol al 10%, registrándose el número de lances ejecutados. En el laboratorio se procedió a su identificación y agrupación por especies, cuantificándose y registrándose el peso total por especie. Los peces fueron identificados empleando descripciones y claves de Kullander (1986), Gery (1977), Vari (1984, 1989 a, 1989 b, 1991, 1992 a, 1992 b) y clasificados de acuerdo al orden descrito en Ortega y Vari (1986), Ortega (1991) y Chang y Ortega (1995). Tanto la densidad (ind. m-2) como biomasa (g. m-2) están referidos al área cubierta por las redes descritas. La abundancia relativa o captura por unidad de esfuerzo (cpue) está expresada en g. lance -1. Se emplearon los índices comunitarios de diversidad de Shannon-Wiener (H' = -S pi log2pi ), diversidad máxima (Hmáx = 1/log2 S) y equitabilidad (H'/Hmáx); donde: S= número de especies, pi = participación relativa de la especie i en la muestra. Toda la información se agrupó por época del año y estación de muestreo. Para conocer la constancia de las especies en las muestras se usó el criterio de Bertoletti et al. (1989) clasificándose a las especies como constantes (a las que presentan un registro superior al 50% en las colectas), accesorias (entre 25 y 50% inclusive) y accidentales (inferior a 25%).
Resultados
Características Físico-químicas
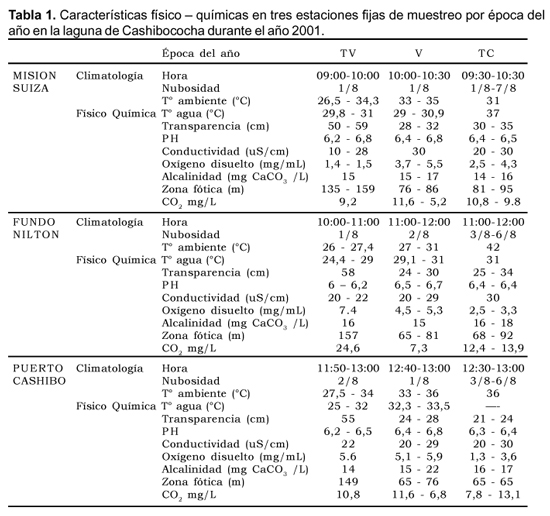
Cashibococha presenta aguas de color verdoso a café oscuro, con pH ligeramente ácido (6-6,8), Conductividad entre 10 y 30 mS.cm -1, Transparencia de 21 a 59 cm y Alcalinidad Total entre 14 y 22 mg CaCO3 / L . La temperatura superficial del agua osciló entre 24,4 y 37º C y el Oxígeno Disuelto entre 1,3 y 7,4 mg / L (Tabla 1). La transparencia fue mayor en la época de Transición a Vaciante, el pH en Vaciante y la Conductividad y Alcalinidad Total en Transición a Creciente.
Bacteriología
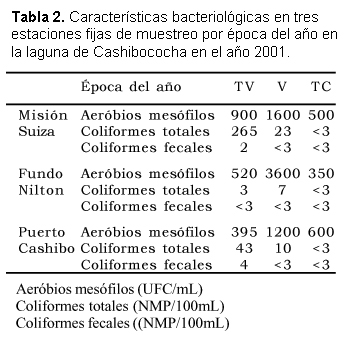
Los análisis bacteriológicos registraron recuentos de aerobios mesófilos entre 350 y 3600 UFC/ mL, con concentraciones altas en la época de Vaciante. Los coliformes totales alcanzaron su mayor concentración en la época de Transición-Vaciante en la estación Misión Suiza y valores que oscilaron entre 3 y 43 NMP/ 100 mL en la época de Transición-Vaciante y Vaciante, en Creciente las lecturas resultaron inferiores a 3 NMP/ 100 mL. Los coliformes fecales fueron inferiores a 3 NMP/ 100 mL con excepción de la estación Misión Suiza y Puerto Cashibococha en Transición-Vaciante (Tabla 2).
Macrófitas acuáticas
Se diferenciaron 47 especies pertenecientes a 20 familias. El mayor número de especies se reportó durante la época de Transición-Creciente, debido a la inundación del bosque, sin embargo en la estación Puerto Cashibococha se obtuvo un mayor reporte de especie en la época de Vaciante (Tabla 3).
Fitoplancton
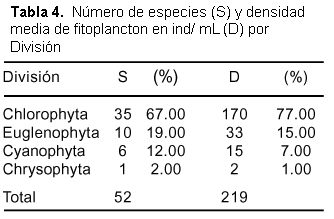
Fueron identificadas 52 especies. La División Chlorophyta presentó el mayor número de especies, seguida de Euglenophyta, Cyanophyta y Chrysophyta. Las Chlorophytas fueron dominantes en densidad, siguiendo el orden descrito para el número de especies (Tabla 4).
La densidad promedio total de fitoplancton fue menor en la época de Transición-Vaciante a Transición-Creciente, siendo esta tendencia la seguida por Euglenophyta y Chrysophyta. Las Chlorophytas mostraron mayores densidades en Vaciante y las Cyanophytas en Transición-Vaciante (Fig. 2).
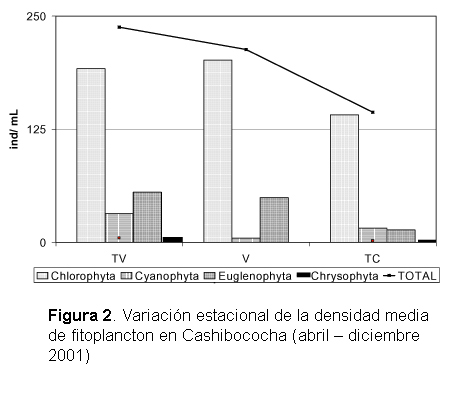
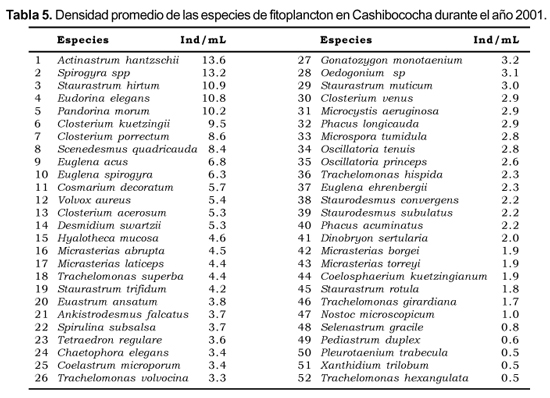
La comunidad fitoplanctónica está dominada por las especies Actinastrum hantzschi, Spirogyra sp, Eudorina elegans, Pandorina morum y Closterium kuetzingui, con densidad promedio superior a 10 ind. mL -1 (Tabla 5).
Zooplancton
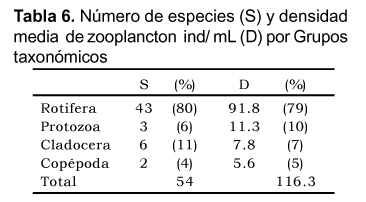
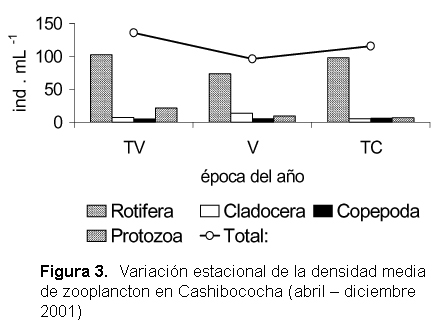
Se diferenciaron 54 especies (considerando a los subórdenes de copépodos como representantes de especies diferentes). Los rotíferos reportaron el mayor número de especies, seguido de Cladocera, Protozoa y Copépoda. El orden Rotifera también fue claramente dominante en densidad total promedio, seguido de Protozoa, Cladocera y Copépoda. (Tabla 6).
La densidad total promedio presenta un descenso en la Transición-Vaciante, recuperándose en la Transición-Creciente, siguiendo la tendencia de los rotíferos; sin embargo, los cladóceros y copépodos muestran sus mayores densidades en Vaciante. Los protozoos muestran densidades decrecientes de la Transición-Vaciante a Transición-Creciente (Fig. 3).
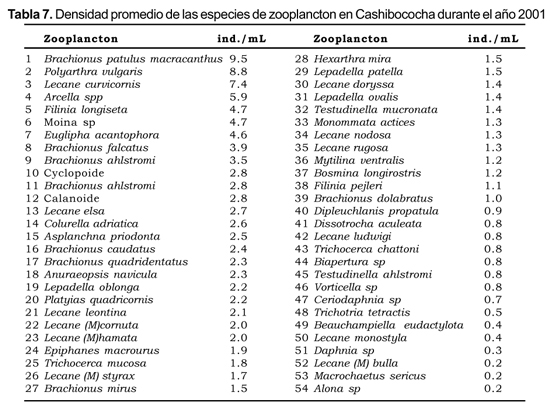
La densidad de zooplancton está dominada por Brachionus patulus macracanthus y Polyarthra vulgaris, con densidades promedio superiores a 8 ind . mL -1 (Tabla 7).
Ictiofauna
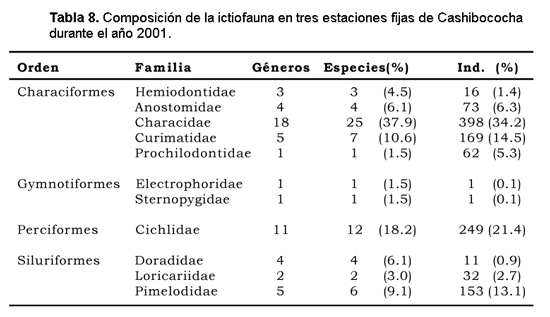
Fueron identificadas 66 especies, pertenecientes a 55 géneros, 11 familias y 4 ordenes. El orden dominante en número de ejemplares capturados fue Characiformes (61,6%), seguido de Perciformes (21,4%), Siluriformes (16,8%) y Gymnotiformes (0,2%). Considerando el número de especies, el orden Characiformes presentó la mayor diversidad (40 especies), siendo la familia Characidae, de las cinco familias reportadas para este orden, la que presentó el mayor número de especies (25). Los Perciformes, con una sola familia obtuvieron 12 especies y los Siluriformes, con tres familias totalizaron 12 especies. Los Gymnotiformes estuvieron representados por dos familias con una sola especie cada una (Tabla 8).
De acuerdo a la presencia en las capturas fueron consideradas constantes 8 especies, 12 accesorias y 46 accidentales, como se muestra en la lista sistemática de las especies capturadas en la laguna (Tabla 9).
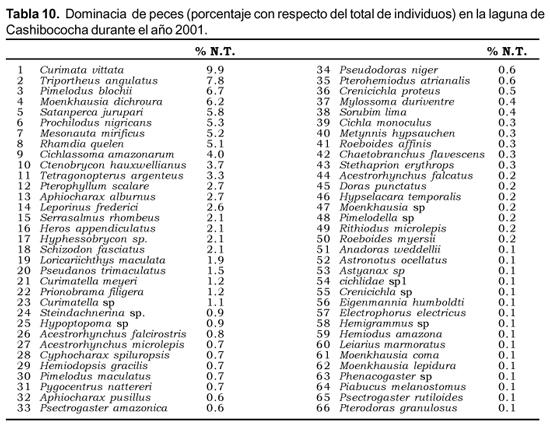
Curimata vittata fue la especie dominante en la comunidad de peces en éstas áreas litorales (Tabla 10).
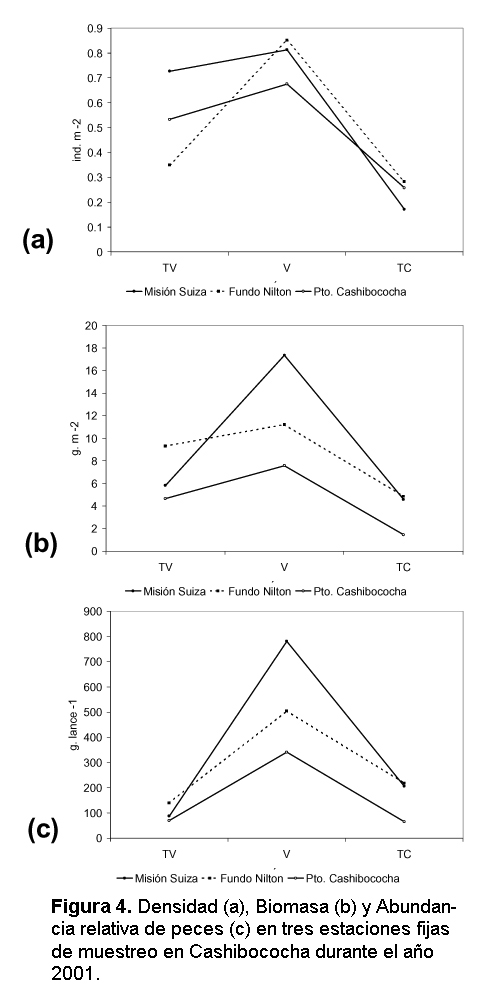
Tanto la densidad total, biomasa y abundancia relativa de peces mostraron ser mayores en vaciante (Fig. 4).
Los valores del índice de diversidad fueron superiores a 3,0 bits. ind -1, en todas las estaciones y lugares de muestreo, con excepción de la estación Misión Suiza en vaciante con 0,7 bits. ind-1. De igual manera los valores de equitabilidad fueron superiores a 0,8 en todas las estaciones y lugares de muestreo con la excepción de la E1 en vaciante con un valor de 0,6 ( Tabla 3).
Discusión
El año 2001 puede ser considerado como un año de gran creciente ya que los niveles del río Ucayali mostraron ser superiores al patrón obtenido para el periodo 1987 - 2001 (Fig.1). Las características físico químicas de Cashibococha la tipifican como un cuerpo de agua negra, de acuerdo a la clasificación de Sioli (1984), con pH ligeramente ácido, baja alcalinidad, baja conductividad y moderada transparencia. De acuerdo a estas características se puede deducir que la alcalinidad está representada por bicarbonatos deduciéndose de ello la baja productividad.
Los valores de colimetría indican que en este cuerpo de agua tiene poca contaminación fecal, lo que aunado al factor de dilución por efecto de las lluvias y crecientes reportan valores inferiores a los límites permisibles de acuerdo a la Ley General de Aguas (D. S. 007-83 SA). Consideramos así que las crecientes y su efecto de dilución actúan como un mecanismo de autopurificación.
Como se puede observar en la Tabla 3, las macrófitas adquieren mayor importancia en la creciente, por la formación de biotopos que sirven como lugares de refugio para muchas especies de peces en sus estadios tempranos de vida y donde además habita una alta diversidad de plancton (Samanéz, 1996). Esta zona es además importante como lugar de alimentación, ya que los frutos, semillas, insectos asociados a este tipo de vegetación constituirán parte de la dieta de muchas especies de peces, principalmente las omnívoras. La descomposición que ocurre durante las crecidas formará parte del reciclaje de nutrientes causando una elevación de estos y un aporte de detritus que es aprovechado por las especies iliófagas (Junk, 1980; Goulding, 1981; Welcomme, 1985).
La vegetación conformada por Paspalum, Ludwigia, Eichornia es la más frecuente en esta zona. Las Ciperaceas y Poaceas son dominantes, de estas las Poaceas reporta el mayor número de especies.
La División Chlorophyta es dominante en el fitoplancton, siendo la presencia y dominancia de esta y especialmente las Desmidiaceae indicadoras de aguas ácidas, sin embargo en lagos tropicales los diferentes grupos de algas se distribuyen independientemente de las condiciones tróficas del ambiente, lo que no permite caracterizar su estado trófico considerando solamente la comunidad fitoplanctónica. El incremento de fitoplancton en la época de Transición-Vaciante puede ser asociado a las variaciones en la transparencia obtenida por el disco Secchi (Tabla 1), siendo la profundidad de la capa fótica mucho mayor en esta época (1,47 - 1,57 m). La disminución en Vaciante se puede deber a la disminución de la vegetación flotante y a la menor profundidad de la capa fótica (0,61 - 0,88 m). No tenemos datos de creciente para compararlos con los de Welcomme (1985) donde manifiesta que existe una correlación negativa entre la abundancia de fitoplancton y el nivel del río, sugiriendo además que aunque la abundancia relativa, en términos de número por unidad de volumen es baja durante las inundaciones, la abundancia absoluta podría ser la misma debido a la dilución del número de organismos por el enorme incremento del volumen de agua en el ecosistema. Nuestros datos parecen contradictorios, pero coinciden con los reportados por Burga et al. (2000) quien halló en Pañacocha (Loreto, Perú) un incremento en el número de géneros en creciente y el menor número en vaciante. En nuestro caso es posible que la abundancia de fitoplancton esté asociada, además de lo anteriormente dicho, a la presencia de macrófitas en estas áreas litorales.
En este cuerpo de agua se ha planteado realizar cultivo de peces, por lo cual es importante considerar que las descargas de los cultivos provocan cambios en el cuerpo de agua receptor y en los sedimentos del fondo por la eliminación de los desechos metabólicos y alimentos no ingeridos. La liberación de nutrientes orgánicos solubles (fósforo y nitrógeno) puede provocar la eutroficación y ésta la hipoxia o anoxia en el cuerpo de agua, enriquecimiento orgánico del ecosistema béntico, aumento del consumo de oxígeno y en casos extremos liberación de anhídrido carbónico, metano y sulfuro de hidrógeno con la consiguiente reducción de la biota (Akiyama, 1996; Pérez, 1996). Es importante mencionar además la presencia en Cashibococha de Mycrocystes aureoginosa que produce toxinas que causan intoxicación en el ganado, el hombre, peces y muerte de otras algas (Roldán, 1992; Eler et al., 2001), por lo que consideramos de gran importancia el monitoreo de sus densidades poblacionales por constituir un riesgo para la salud.
El zooplancton muestra una reducción en Vaciante y recuperación en Transición-Creciente debido posiblemente a la disminución de las macrófitas durante la Vaciante. A pesar de la posible sub estimación de los protozoarios, por la metodología de colecta y el método de preservación, éstos mostraron altas densidades, lo cual refleja la importancia que tiene este grupo dentro de la comunidad, cumpliendo un rol fundamental en la transferencia de energía en el ecosistema. Los rotíferos fueron el grupo dominante en el zooplancton, marcando el pulso de la producción zooplactónica en su conjunto, coincidiendo con Welcomme (1985). La información disponible evidencia una relación directa con el nivel del río. Por otro lado, Roldán (1992) considera que la presencia de un mayor número de rotíferos y cladóceros que copépodos son indicadores de aguas eutróficas lo que indicaría el estado trófico de Cashibococha, basado en el zooplancton.
El necton (peces) es más diversificado y con mayor densidad durante la vaciante, debido a la retracción de las aguas que obligan a su concentración en el cuerpo de agua. Durante la crecida estos peces se hallan en el bosque inundado aprovechando de los biotopos que se forman durante ésta época. Estas características se evidencian en las variaciones estacionales de los índices de abundancia relativa, densidad y biomasa, siendo más altos en Vaciante. El número de especies identificadas (66 especies) puede ser considerado alto. Antúnez y Sánchez (2000) identificaron 64 especies de peces en Urcococha, considerando a esta laguna como de alta riqueza específica, aunque este cuerpo de agua es diferente a Cashibococha por sus características físico químicas (pH 6.25 - 8.28, Conductividad 109.8 - 180.9 mS.cm-1). Los índices de diversidad de Shannon-Wiener pueden ser considerados altos si tomamos a 3,0 bits. ind -1 como un valor referencial (Goulding et. al., 1988), siendo los valores en Cashibococha superiores en todas las estaciones de muestreo y épocas del año, con la excepción en la época de Vaciante en la Misión Suiza, donde existe un puerto y se limpia la vegetación flotante y circundante (Tabla 3). Los valores de equitabilidad son un indicador del grado de dominancia de especies. Ferreira y Jégu (1988) consideran que valores superiores a 0,8 son indicadores de comunidades en equilibrio. La equitabilidad en Cashibococha es alta indicando que no hay una concentración de individuos en pocas especies y sugiere que la comunidad de peces está en equilibrio, sin embargo en la época de Vaciante en la estación Misión Suiza el valor es de 0,6 lo que puede deberse a alteraciones en el sistema con dominancia de unas especies. El número alto de especies consideradas accesorias, es una característica común a los trópicos y muchas de ellas pueden ser consideradas visitantes ocasionales.
Agradecimientos
A los Biólogos Javier Zaldívar y César Villanueva y a los Técnicos en Biología Jorge Gahona Cevedón y Victor Muñoz Pezo por el apoyo el las labores de campo.
Literatura citada
APHA 1989. Standard methods for the Examination of Water and Wastewater, 16ava. Ed. American Public Health Association, Washington, D.C. [ Links ]
Akiyama, Dean. 1996. Impacto ambiental del cultivo de peces en jaulas. Tema VII. Soyanoticias. pág. 21. [ Links ]
Antúnez C.M.S., Sánchez R.H. 2000. Distribución cualitativa y aspectos bioecológicos de los peces ornamentales de Urcococha (Yanamono, Río Amazonas). Rev. Conoc. 6 (1) : 1 - 11. [ Links ]
Bertoletti, J. J.; Lucena C. A. S. De ; Lucena Z. M. S. De ; Malabarba L. R. y Reis R. E. 1989. Ictiofauna do Rio Uruguay Superior entre os Municipios de Aratiba e Esmeralda, Rio Grande do Sul, Brasil. Comun. Mus. Cién. PUCRS. Porto Alegre, nº 48. p. 3-42. [ Links ]
Brako, L. & J. Zarucchi. 1993. Catalogue of the Flowering Plants and Gymnosperms of Peru. Missouri Botanical Garden, Monographs in Systematic Botany 45: 1-1286. [ Links ]
Burga C.A. del P., Bendayán A.M., Pezo D.R. 2000. Evaluación cualitativa del fitoplancton en la laguna Pañacocha, Río Nanay, Loreto, Perú. Rev. Conoc. 6 (1) : 23 - 35. [ Links ]
Chang, F. and H. Ortega. 1995. Additions and corrections to the list of freshwater fishes of Peru. Publ.Mus.Hist.nat. UNMSM (A)50:1-11[ [ Links ]STANDARDIZEDENDPARAG]
Chocano, L. 2002. Diversidad ictiológica de la laguna de Cashibococha (Ucayali-Perú). XI RC ICBAR. 24-26 abril del 2002. Fac. Ciencias Biológicas. UNMSM. Libro de Resúmenes. p. 34. [ Links ]
Eler, M. N., P. S. Ceccarellf, A. G. M. Bufon y E. L. G. Espíndola. 2001. Mortandade de peixes (matrinxa, Brycon cephalus, e pacu, Piaractus mesopotamicus) associada a uma floracao de cianobacterias en pesque-pague, município de Descalvado, estado de Sao Paulo, Brasil. Boletim Técnico do CEPTA, Pirassununga, v. 14, p. 35-45. [ Links ]
Ferreira E., G.M.S. y Jégu M. 1988. Aspectos ecológicos da ictiofauna do Rio Mucajai, na àrea da ilha Paredao, Rorarima, Brasil. Amazoniana. X (3) : 339 - 352. [ Links ]
Gery, Jacques. 1977. Characoids of the world. T.F.H. Publications, Inc. Ltd. USA. 672 p. [ Links ]
Goulding, M. 1981. Man and fisheries on an Amazon frontier. Developments in hidrobiology 4. Dr. W.Junk Publishers. The Hague. Boston. London. 137 p. [ Links ]
Goulding, M., Carvalho, M.L., R. Ferreira, E.G. 1988. Rio Negro. Rich life in poor water Amazonian diversity and foodchain ecology as seen through fish communities. The Hague: SPB Academic publishing, 200 pp. [ Links ]
Junk, W. J. 1980. Areas inundáveis. Um desafio para Limnología. ACTA AMAZONICA 10 (4) : 775 - 795. [ Links ]
Kann, F. León, B. Young, K. 1993. Las plantas vasculares en las aguas continentales del Perú. IFEA. Lima-Perú. [ Links ]
Kullander, S. 1986. Cichlid fishes of the Amazon River drainage of Perú. Stockholm, Sweden. 431 p. [ Links ]
Ortega, H. 1991. Adiciones y correcciones a la lista anotada de los peces continentales del Perú. Publ.Mus.Hist.nat. UNMSM (A)39:1-6[ [ Links ]STANDARDIZEDENDPARAG]
Ortega, H, & R. P. Vari. 1986. Annotated Checklist of the Freshwater Fishes of Peru. Smithsonian Contributions to Zoology 437: 1-25. [ Links ]
Pérez, J. E. 1996. La acuicultura y la conservación de la biodiversidad. INTERCIENCIA. Vol 21 nº 3: 154-157. [ Links ]
Pimentel, V. L. y B. Rengifo. 1997 (Ed). Gran Enciclopedia de la Región Ucayali. VIDEORIENTE EDITORES. Editorial Navarrete. Lima - Perú. 189 p. [ Links ]
Prescott, G. W. 1975. Algae of the Western Great Lakes Area. WM.C.Brown Company Publishers. USA. [ Links ]
Roldán P., Gabriel. 1992. Fundamentos de limnología neotropical. Editorial Universidad de Antioquia. Medellín. Colombia. 529 p. [ Links ]
Samanéz, I. 1979. Algas de Pucallpa y alrededores. Ser. Divulgación Nº10. Museo de H. Natural. Departamento de Botánica. Lima-Perú. [ Links ]
Samanéz, I. 1988. Rotiferos Planctónicos de la Amazonia Peruana. I. Rotiferos del Departamento de Ucayali. Revista peruana de Biología 3(1): 141-167. [ Links ]
Samanéz, I. 1996. Ecología de comunidades biológicas en Cashibococha. Teorema. UNMSM. Año 5. nº 7. p. 120-121. [ Links ]
Samanéz, I. y F. Zambrano, 1995. Observaciones sobre la Diversidad y algunas características ecológicas del plancton en el departamento de Madre de Dios, Peru. [ Links ]
Sioli, H. 1984. The Amazon and its main affluents: hydrography, morphology of the rivers courses, and river types. The Amazon. Limnology and landscape ecology of mighty tropical river and its basin (ed. By H. Sioli). Pp 127 - 165. Dr. W. Junk, The Hague. [ Links ]
Vari, Richard. 1984. Systematics of the Neotropical characiform genus Potamorhina (Pisces: Characiformes). 36 p. [ Links ]
Vari, Richard. 1989 a. Systematics of the Neotropical characiform genus Curimata Bosc (Pisces: Characiformes).63 p. [ Links ]
Vari, Richard. 1989 b. Systematics of the Neotropical characiform genus Psectrogaster Eigenmann and Eigenmann (Pisces:Characiformes). 43 p. [ Links ]
Vari, Richard. 1991. Systematics of the Neotropical characiform genus: Steindachnerina Fowler (Pisces: Ostariophysi). 118 p. [ Links ]
Vari, Richard. 1992 a. Systematics of the Neotropical characiform genus Cyphocharax Fowler (Pisces: Ostariophysi). 137 p. [ Links ]
Vari, Richard. 1992 b. Systematics of the Neotropical characiform genus Curimatella Eigenmann and Eigenmann (Pisces: Ostariophysi), with summary comments on the Curimatidae. 48 p. [ Links ]
Welcomme, R. L. 1985. River fisheries. FAO. Fisheries Technical Paper 262. 330 p. [ Links ]
* Proyecto Nº 011001061 (FEDU-CSI-UNMSM)
1 Correspondecia
Instituto Veterinario de Investigaciones Tropicales y de Altura (IVITA-Pucalpa), Daniel Alcides Carrión 319 - Pucallpa.
E-mail: Jose Riofrío joseriofrio@hotmail.com













