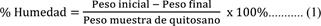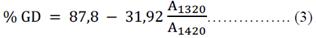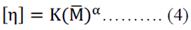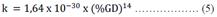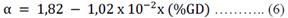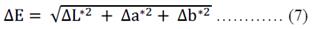INTRODUCCIÓN
El pardeamiento enzimático es la oxidación de compuestos fenólicos, catalizada principalmente por la enzima polifenoloxidasa (PPO), esta oxidación produce quinonas, las cuales se condensan y reaccionan rápidamente formando un conjunto de pigmentos oscuros indeseables (melaminas), causando una serie de cambios negativos en la calidad nutricional y sensorial, por ello, el pardeamiento enzimático ha sido preocupación importante en la industria y ciencia de los alimentos1.
Por otro lado, el quitosano es un producto natural, biodegradable y no tóxico, donde su principal característica es la capacidad de inducir mecanismos de resistencia en el fruto modificado, además se están realizando evaluaciones del efecto sinérgico entre el quitosano y otros productos de origen natural como posibles alternativas de control a los problemas de postcosecha y frutas procesadas2.
La chirimoya cultivada en Perú posee una alta aceptación en el mercado nacional e internacional debido a sus atributos sensoriales (sabor, textura, aroma, entre otros), sin embargo, el principal problema es el pardeamiento de la pulpa causado por la enzima polifenoloxidasa, que en la chirimoya, perteneciente al género Annona, solo se puede evitar con productos químicos, pues utilizar altas temperaturas provoca el desarrollo de sabores extraños, limitando la producción y posterior comercialización, por esta razón es considerado un cultivo de subsistencia a causa del bajo acceso a tecnología adecuada3, por consiguiente, se busca alternativas de conservación, con el fin de desarrollar tecnologías simples y económicas que retrasen los procesos de deterioro y mantengan la calidad e inocuidad microbiológica de los productos.
La industrialización de la pulpa de chirimoya logrará abrir nuevos mercados, tales como empresas de helados, pastelerías, entre otros, incrementando la demanda de este producto, reduciendo las pérdidas causadas por el deterioro de la fruta durante la manipulación y el transporte, asimismo al producir pulpa de chirimoya se obtiene un producto con valor agregado, por tanto, una alternativa de solución al problema socioeconómico presente en las zonas rurales productoras de este fruto.
El presente trabajo de investigación radica en buscar nuevas alternativas para la conservación de la pulpa de chirimoya evaluando su potencial efecto sinérgico entre el quitosano (CS) y el ácido cítrico (AC), con la finalidad de ampliar la vida útil durante su almacenamiento en congelación, manteniendo las propiedades fisicoquímicas propias de la chirimoya fresca y a su vez conservar sus características sensoriales.
PARTE EXPERIMENTAL
El desarrollo del procedimiento experimental se llevó a cabo en el “Laboratorio de Investigación y Desarrollo de Química Orgánica” y el “Laboratorio de Síntesis Orgánica” del departamento de Química Orgánica correspondiente a la Facultad de Química e Ingeniería Química de la Universidad Nacional Mayor de San Marcos.
Materia prima e insumos
Chirimoya procedente del pueblo anexo La Merced de Chaute, distrito de San Bartolomé, provincia de Huarochirí, región Lima, ubicada a 2491 msnm.
Quitosano obtenido de la quitina extraída a partir del residuo pluma de pota recolectada en el Terminal Pesquero del distrito de Ventanilla (Callao - Perú). Ácido cítrico (E330) - Procedente de la empresa peruana Marva S.A.C.
Procedimiento experimental
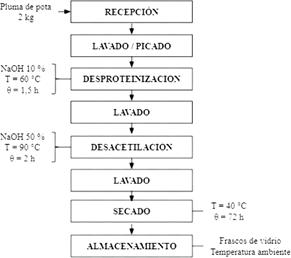
El presente trabajo de investigación comprende dos etapas: Obtención del quitosano a partir de la pluma de pota (Figura 1). La pluma de pota recepcionada pasó por el proceso de lavado, picado, desproteinización utilizando NaOH 10%, luego fue lavado consecutivamente hasta llegar a pH neutro para volver a ser atacado por NaOH 50% hasta lograr su desacetilación parcial del biopolímero, se lavó consecutivamente hasta llegar a pH neutro, finalmente fue llevado a estufa hasta su secado, siendo almacenado en un envase de vidrio.
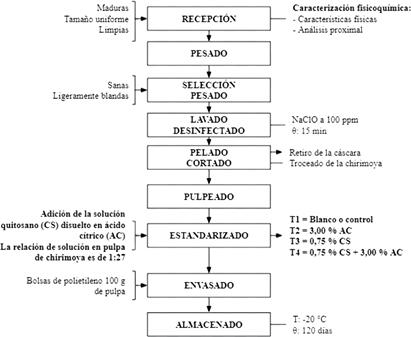
La obtención de la pulpa de chirimoya (Figura 2). Las chirimoyas se recepcionaron en el laboratorio, donde se seleccionaron las frutas maduras, sanas y de tamaño uniformes, luego se lavaron y desinfectaron, posteriormente se realizó el pelado, pulpeado y estandarizado con los diferentes tratamientos de quitosano y ácido cítrico. Las soluciones formadas fueron agitadas durante a 800 rpm, 70°C durante 4 h. Se formaron 4 soluciones:
Tratamiento control o blanco (T1): Agua destilada
Tratamiento 2 (T2): Solución de ácido cítrico al 3%
Tratamiento 3 (T3): Solución de quitosano al 0,75%
Tratamiento 4 (T4): Solución de quitosano al 0,75% y ácido cítrico al 3%
Las diferentes soluciones se añadieron a la pulpa de chirimoya en relación de 1/27 respectivamente. Las muestras de pulpas estandarizadas se envasaron y almacenaron en congelación hasta su posterior análisis.
Caracterización del quitosano obtenido
Humedad. Se colocaron 1,5 g de quitosano en estufa durante 48 h a 70 °C hasta obtener un peso constante. El porcentaje de humedad se obtiene a partir de la siguiente ecuación 1:
Cenizas. Se llevó a mufla 1,5 g de quitosano durante 8 h a 500 °C, luego se dejó enfriar en un desecador hasta llegar a temperatura ambiente. El porcentaje de cenizas se obtuvo a partir de la siguiente ecuación 2:
Grado de desacetilación. Se mezclaron 2 mg de quitosano con 98 mg de KBr, colocando la mezcla en el pastillador durante 30 min, por último, se colocó la pastilla formada en el equipo IR, mediante el software del equipo se obtuvo el espectro de la muestra, reportando las absorbancias para la frecuencia de 1320 cm-1 y 1420 cm-1. El grado de desacetilación se calculó aplicando la siguiente ecuación 3:
Peso molecular. Mediante la ecuación 4 de Mark-Houwink se determinó el peso molecular del quitosano4.
Donde:
η: Viscosidad intrínseca (ml/g).
K,α: Constantes que varían según el grado de desacetilación del polímero. M: Peso molecular (KDa).
Empleando las ecuaciones 5 y 6 se halló los valores de las constantes K y α en función del porcentaje del grado de desacetilación4.
Selección de la variedad de chirimoya
Rendimiento del fruto. Con el fin de determinar la proporción de cáscara, semillas y pulpa se separó las tres partes mencionadas para ser pesadas en una balanza de mesa, obteniendo el porcentaje de pepa, cáscara y pulpa para cada variedad.
Estudio de la actividad sinérgica
Contenido de polifenoles totales. El contenido total de polifenoles se determinó aplicando el método de Folin Ciocalteu basado en la descripción de García et al.5 con algunas modificaciones. Se pesó 2,5 g de pulpa de chirimoya y se añadió 5 ml de etanol puro, homogeneizando el contenido mediante agitación constante durante 2 min, luego se filtró el contenido con tela de organza recuperando el líquido sobrenadante, el cual contiene los compuestos polifenólicos presentes en la pulpa de chirimoya. En cada vial se añadió 3,9 ml de agua destilada, agregando 50 µL de la extracción de los compuestos polifenólicos o de cada disolución patrón de ácido gálico, en seguida, se añadió 250 µL del reactivo Folin Ciocalteu, dejando reposar todo el contenido durante 8 min en oscuridad. Transcurrido el tiempo, se le adicionó 750 µL una solución de Na2 CO3 al 7,5%, dejándolo reposar durante 2,5 h a temperatura ambiente y en oscuridad. Finalmente, la lectura del contenido total de polifenoles se cuantificó midiendo su absorbancia a una longitud de onda de 765 nm.
Actividad de la Polifenoloxidasa. Se utilizó el método espectrofotométrico, pesando 2,5 g de pulpa y homogeneizando con 10 ml de buffer McIlvaine (pH 7,0) durante 30 s, luego se filtró desechando el residuo sólido, finalmente la solución filtrada se centrifugó a 2000 rpm durante 10 min, siendo el líquido sobrenadante el extracto que contiene la enzima polifenoloxidasa.
Se utilizó como sustrato al pirocatecol, en una cubeta se añadió 2,5 ml de pirocatecol a 0,01 M y 100 µL del extracto enzimático, como blanco se tomó 2,5 ml de pirocatecol y 100 µL del buffer McIlvaine (pH 7,0). Se realizaron lecturas de absorbancia a 400 nm cada 10 s durante 2 min en un espectrofotómetro UV - Vis. Una unidad de la enzima polifenoloxidasa, se define como la cantidad de extracto enzimático que causa un aumento en la absorbancia de 0,001 unidades por minuto.
Variación del color. La variación del color (∆E) producido en la pulpa de chirimoya durante los 120 días de almacenamiento se registró utilizando el sistema CIE-Lab, donde se midió los parámetros L*, a* y b*. El parámetro L* nos muestra valores de luminosidad u oscuridad, mientras que el parámetro a* nos indica la variación del color rojo - verde, siendo positivo (+a) para el color rojo y negativo (-a) el color verde, mientras que los valores del parámetro b nos explica la variación del color amarillo - azul, donde valores positivos (+b) indica el color amarillo y valores negativos el color azul6. La variación del color (∆E) se obtuvo luego de aplicar la ecuación 7, especificada en la norma europea EN 12878:
Análisis de la información
Durante el proceso de evaluación de la actividad sinérgica se recopilaron cada uno de los datos por triplicado, los cuales fueron mostrados como el promedio ± la desviación estándar empleando Hoja de Cálculo de Google Drive. Para el tratamiento estadístico en la selección de la variedad de chirimoya se utilizó un Diseño Completamente al Azar (DCA), en tanto para la evaluación de la actividad sinérgica presente en la pulpa de chirimoya, el Diseño de Bloques Completamente al Azar (DBCA) con un arreglo factorial 2x2, cuyos datos fueron analizados mediante el software estadístico InfoStat versión 2019 realizando el análisis de varianza de los factores (ANOVA) con un nivel de significancia de 0,05 aplicando la prueba de comparaciones múltiples de Tukey para determinar si existe diferencia significativa entre los tratamientos evaluados.
RESULTADOS Y DISCUSIÓN
Caracterización del quitosano
Debido a la importancia de los grupos aminas presente en la estructura química del quitosano, se realizó la caracterización de este biopolímero tomando en cuenta su porcentaje de humedad, contenido de cenizas, peso molecular y el grado de desacetilación, dichos resultados se detallan en la Tabla 1.
Tabla 1 Caracterización del quitosano.
| Humedad (%) | Cenizas (%) | Peso molecular (KDa) | Grado de desacetilación (%) |
|---|---|---|---|
| 10,52 | 0,35 | 846 | 78,2 |
Experimentalmente se determinó un valor de 0,35% de cenizas para el quitosano extraído de la quitina presente en la pluma de pota (Dosidicus gigas), siendo este un resultado muy bajo a comparación de los reportados por otros autores en la caracterización del quitosano proveniente de distintas fuentes de materia prima. Posiblemente, el bajo contenido de cenizas, se deba a las características y cualidades que presenta la quitina obtenida a partir del cartílago (pluma) del calamar gigante o pota, cuya fuente carece de material calcáreo y se ubica en el interior del cefalópodo, por lo que, no se lleva a cabo una bioacumulación directa de metales inorgánicos como el plomo (Pb), mercurio (Hg), arsénico (As), cadmio (Cd), cromo (Cr), Zinc (Zn) y Níquel (Ni) a diferencia de la quitina que se encuentra en el exoesqueleto de moluscos y crustáceos, donde la exposición con estos metales pesados, producto de la contaminación del mar peruano, ocurre de forma directa logrando obtener porcentajes de cenizas elevadas (>1 %), generando un gran impacto a la salud debido a su alta toxicidad de estos materiales inorgánicos4,7.
El contenido de humedad determinado fue de 10,52 %, cuyo valor es menor comparado con el 14 % de humedad que reportaron para el quitosano extraído a partir de la quitina de camarón8. Los diferentes contenidos de humedad que presentan los compuestos de quitosano se generan, principalmente, por las distintas fuentes de materias primas de obtención, además de los procesos físicos o de reacción bruscos al cual se somete la quitina durante el proceso de desacetilación, disminuyendo su contenido de agua, obteniendo polímeros con diferentes propiedades y características9.
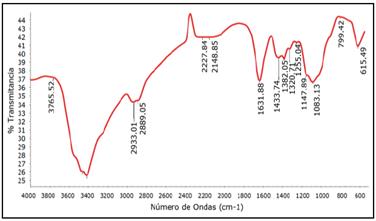
El espectro infrarrojo (IR) obtenido para la muestra de quitosano se detalla en la Figura 3, cuyas bandas de absorción se obtuvieron luego de la interacción entre la energía producida por el espectro infrarrojo y la muestra de quitosano, estas fueron de 3414, 2889, 1433, 1632, 1382, 1321, 1255 y 1083 cm-1.
El pico formado alrededor de 1321 y 1433 cm-1 se le atribuye a la vibración de flexión del enlace C - N presente en el grupo amida y amina respectivamente, las cuales son utilizadas como bandas de medición logrando determinar el porcentaje del grado de desacetilación debido a la posibilidad de hallar la relación que existe entre la cantidad de N-glucosamina y N-acetilglucosamina en el quitosano4. Aplicando la espectroscopía FTIR, el grado de desacetilación para el quitosano obtenido a partir de la pluma de pota fue de 78,2%, cuyo valor se encuentra por debajo de 85,47% del GD reportado por Moreno et al.10, a pesar que el quitosano proviene de la misma fuente de obtención (pluma de pota). Probablemente, esta diferencia de valores, comparando con nuestros resultados, se deba al cálculo de las áreas debajo de las bandas de absorción en 1321 y 1433 cm-1, las cuales se tomaron como referencia siguiendo la metodología propuesta por Castro4.
La obtención del grado de desacetilación es una propiedad determinante en la clasificación del polímero como quitina o quitosano, siendo considerado como quitina si presenta un valor menor del 50 % del grado de desacetilación4. Por los resultados obtenidos (78,2% del GD) y los grupos funcionales reconocidos en el espectro IR, se puede afirmar que el biopolímero obtenido a partir de la pluma de pota es clasificado como quitosano.
Otras de las evaluaciones muy recurrentes en la caracterización del quitosano es la determinación de su peso molecular, experimentalmente se obtuvo un peso molecular de 846 KDa, este resultado es menor comparado a lo obtenido por Moreno et al.10, quienes determinaron un peso molecular de 1055 KDa del quitosano proveniente de la misma materia prima.
Selección de la variedad de chirimoya
En la Tabla 2 se indican los rendimientos (en porcentaje) para las diferentes variedades de la chirimoya. Siendo la variedad Lisa, la de menor rendimiento en cáscara (26,31%) y pepa (3,10%) a diferencia de las otras dos variedades (Impresa y Umbonata). Sin embargo, el rendimiento en pulpa de la variedad Lisa fue de 70,07%, resultado mayor a comparación de la variedad Impresa (63,74%) y Umbonata (66,37%).
Tabla 2 Valores promedio del rendimiento de cáscara, pepa y pulpa para las tres variedades de chirimoya.
| Variedad | Rendimiento de cáscara (%) | Rendimiento de pepa (%) | Rendimiento de pulpa (%) |
|---|---|---|---|
| Lisa | 26,31& ± 1,33 | 3,10& ± 0,22 | 70,07& ± 2,01 |
| Impresa | 28,65* ± 0,77 | 7,16/ ± 0,41 | 63,74* ± 2,96 |
| Umbonata | 29,23* ± 1,34 | 6,26* ± 0,49 | 66,37&* ± 2,23 |
Nota. Los valores luego del signo ± indican la desviación estándar. Las letras A, B o AB, situadas como superíndice en las medias, son una simbología práctica, donde la letra común no es significativamente diferente.
De los diferentes análisis estadísticos, se deduce que la chirimoya variedad Lisa es apropiada para procesar a nivel industrial, esto debido a los resultados en rendimiento de cáscara, pepa y pulpa, evidenciando el mayor aprovechamiento de la fruta a comparación de las otras dos variedades.
Estudio de la actividad sinérgica entre quitosano y ácido cítrico en la pulpa de chirimoya
Con la finalidad de observar una posible acción sinérgica del quitosano junto al ácido cítrico para controlar el pardeamiento enzimático en la pulpa de chirimoya, se evaluó la variación de los compuestos fenólicos durante 120 días de almacenamiento a -20°C, permitiendo estudiar la posible interdependencia entre el contenido de polifenoles totales y el desarrollo de este fenómeno enzimático. La Figura 4 muestra la variación en contenido de polifenoles totales para cada tratamiento estudiado, los resultados se expresan en mg de ácido gálico/100g de pulpa de chirimoya.

Figura 4 Variación del contenido de polifenoles totales con respecto a los días de almacenamiento de la pulpa de chirimoya.
Durante los 120 días de evaluación, los cuatro tratamientos mostraron una caída de los compuestos polifenólicos, esto probablemente se deba a la degradación oxidativa que sufre estos compuestos al reaccionar con la enzima polifenoloxidasa en presencia del oxígeno provocando el pardeamiento enzimático en la pulpa11.
El tratamiento control o blanco (T1) presentó la mayor variación de estos compuestos, registrando una oxidación total de 49,4 mg de ácido gálico/100 g de muestra, sin embargo, el tratamiento T4, cuya solución está formada por la mezcla de quitosano y ácido cítrico, mostró un comportamiento antagónico con una disminución total de 28 mg de ácido gálico/100 g de pulpa, siendo este el tratamiento que presentó menor variación, asimismo los tratamientos T2 y T3 reportaron oxidaciones enzimáticas de 33,8 y 36,17 mg de ácido gálico/100 g de muestra respectivamente. La composición polifenólica que presenta la chirimoya es de gran relevancia en la comprensión de la rapidez del pardeamiento que sufre la pulpa, además en base a las investigaciones realizadas por Barea12, se afirma que la chirimoya presenta, en su perfil polifenólico, cantidades notables de derivados del ácido hidroxicinámico (ácido cafeico, ácido ferúlico y el ácido cumárico), flavonoides y taninos, los cuales son degradados mediante oxidación enzimática produciendo compuestos muy reactivos llamadas quinonas, que al condensarse forman polímeros pardos conocidos como melaminas; por esta razón, el tratamiento control (T1) al no presentar algún agente antioxidante que ayude a controlar la oxidación enzimática, muestra un rápido pardeamiento debido a la alta velocidad de oxidación de los polifenoles presentes en la pulpa, caso contrario a los resultados obtenidos por los tratamientos T4 y T3, formulados con soluciones de quitosano, debido a la capacidad antioxidante que presenta las soluciones de este biopolímero actuando como agente antioxidante secundario por su eficiencia de quelación contra iones metálicos, los cuales ralentizan el inicio de la oxidación13. La propiedad quelante, del quitosano en diferentes alimentos, se debe a la interacción entre el quitosano y iones metálicos de transición y postransición, como por ejemplo el Cu+2, que forma parte del grupo prostético de la polifenoloxidasa dando inicio al pardeamiento enzimático; esta interacción se logra gracias a los grupos aminas e hidroxilos que presenta el quitosano en su estructura química, comportándose como un polielectrolito catiónico, que por debajo de un pH 6,5 presenta una alta densidad de carga formando quelatos con los iones metálicos14.
Además, un pH bajo puede retardar el crecimiento de microorganismos como las bacterias, así también, inactivar enzimas no deseables como la polifenoloxidasa, por esta razón, el ácido cítrico también mostró un efecto significativo con respecto a la variación de los polifenoles totales presentes en la pulpa de chirimoya, debido a su baja actividad por debajo de un pH 4, constituyendo una forma de control del pardeamiento enzimático15. La reducción de la actividad de la PPO provoca una disminución en las reacciones del pardeamiento enzimático, en consecuencia, la oxidación de compuestos polifenólicos a orto-quinonas se vería también reducido.
En la Figura 5 se observa las actividades de la PPO generadas por los tratamientos en estudio, donde T4 presentó la menor actividad enzimática durante toda la evaluación, seguido por los tratamientos T2 y T3, sin embargo, el tratamiento control (T1) presentó la mayor actividad. Según Jiang et al.16 afirman que una elevada actividad enzimática de la polifenoloxidasa afecta en la rapidez del pardeamiento de frutas que presentan concentraciones importantes de compuestos polifenólicos como es el caso de la chirimoya, entonces el tratamiento T1, al poseer una elevada actividad enzimática a comparación del resto de tratamientos, presenta un rápido pardeamiento a causa de la mayor concentración de polímeros pardos producidos, este resultado se encuentra altamente relacionado con los cambios de color que se produce en la pulpa de la chirimoya y la rápida oxidación de sus polifenoles, mostrados en la Figura 4, generando indeseables cambios sensoriales y nutricionales3.
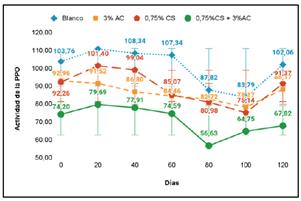
Figura 5 Variación de la actividad de la polifenoloxidasa con respecto a los días de almacenamiento de la pulpa de chirimoya.
La elevada actividad de la PPO, hallada experimentalmente, se puede deber al desorden celular que se genera al recibir daños mecánicos propios del pulpeado, esta explicación se ve reforzada por Morante et al.11, donde mencionan que los tejidos vegetales sin lesión e impacto mecánico, se encuentran en compartimentos diferentes, los sustratos polifenólicos en la vacuola y la enzima polifenoloxidasa en el cloroplasto, evitando una reacción oxidativa, sin embargo, procesamientos industriales como el triturado, cortado o pulpeado aplicados en frutas, puede generar desorganizaciones celulares de estos compartimientos, permitiendo un contacto directo entre la enzima y los mismos compuestos fenólicos.
Los resultados muestran a la solución formulada por la combinación de quitosano (0,75 %) con ácido cítrico (3,0 %) como mejor tratamiento, evidenciando algún modo de interacción o entrecruzamiento entre ambos compuestos que ayudan a potencializar sus propiedades antioxidantes y quelantes obteniendo mejores resultados de inhibición y control del pardeamiento enzimático en la pulpa de chirimoya a comparación de emplear soluciones de quitosano o ácido cítrico independientemente17.
La disminución significativa en la actividad de la PPO tras aplicar una solución de ácido cítrico al 3%, tratamientos T2 y T4, se puede deber a su capacidad acidulante generando ciertos cambios en el pH de la pulpa, por otro lado, Cob et al.18 también indican el efecto que produce la variación del pH respecto a la disminución de la actividad enzimática, siendo la actividad reducida a valores de pH alrededor de 4. Respecto a la baja actividad hallada en la pulpa de chirimoya, para los tratamientos que presentan soluciones de quitosano como parte de su formulación (T3, T4), probablemente se explique por la interacción entre los grupos amina e hidroxilo reactivos del polímero con iones metálicos como el Cu+2, esta capacidad quelante del quitosano se ve afectada por la variación del pH modificando la densidad de carga del polímero14, en consecuencia, los tratamientos T3 y T4 mostraron una disminución de la actividad enzimática, esto posiblemente a los quelatos formados producto de la interacción entre el biopolímero y el cobre. A pesar de las diversas propiedades que brinda el quitosano y el ácido cítrico en el control del pardeamiento, existen investigaciones donde se estudia un posible entrecruzamiento entre ambos compuestos, Chávez et al.17 mencionan que esta reacción se puede dar mediante una esterificación o amidación. El entrecruzamiento por esterificación se obtiene mediante un enlace entre los grupos hidroxilos del quitosano y ácido cítrico, mientras que la reacción de amidación se logra mediante un enlace producido entre el grupo amino del quitosano con el grupo carboxílico del ácido cítrico formando un enlace amida luego de recibir calor. El tratamiento T4, cuya formulación esta compuesta por una solución de quitosano y ácido cítrico, fue agitada durante 4 h a 70°C produciendo, a esta temperatura, un entrecruzamiento entre estos dos compuestos mediante enlaces amida19.
Respecto a la cuantificación de los cambios de color (∆E) producidos en la pulpa de chirimoya durante su almacenamiento, se registraron los valores para los cuatro tratamientos de estudio, donde se calculó en base a la ecuación especificada por la norma europea EN 12878 tomando en cuenta el sistema CIE-lab6.
De la Figura 6 se observa que todos los tratamientos presentaron un similar comportamiento respecto a los cambios del color producidos en la pulpa de chirimoya obteniendo rectas de pendientes positivas cuyas correlaciones lineales fueron adecuadas.
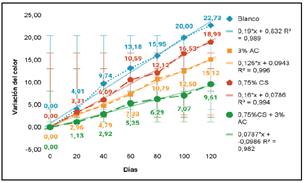
Figura 6 Variación de la actividad de la polifenoloxidasa con respecto a los días de almacenamiento de la pulpa de chirimoya.
El tratamiento T4 presentó una correlación lineal de R2 = 0,982 obteniendo los menores cambios de color durante toda la evaluación, seguido por lo tratamientos donde se involucra agentes antioxidantes de forma independiente, siendo el T3 (R2 = 0,994) quien presentó una recta más pronunciada a comparación del T2 (R2 = 0,996), esto nos indica que existe una mayor variación del color en la pulpa con solución de quitosano (0,75 %) en comparación a la tratada con ácido cítrico (3%), mientras el tratamiento control (T ) con un R2 = 0,989 registró el mayor cambio respecto al color inicial de la pulpa.
El tratamiento control T1 mostró la mayor diferencia total de 22,73 para el día 120, probablemente el rápido cambio de color se encuentra relacionado con la alta actividad de la polifenoloxidasa registrada para la pulpa de chirimoya que no presenta la adición de algún agente antipardeante, de forma antagónica el tratamiento cuya formulación presenta la mezcla entre la solución de quitosano y ácido cítrico (T4) mostró la menor variación total del color (∆E), siendo esta diferencia de tan solo un 9,61 para el último día de evaluación. El efecto sinérgico entre ambos compuestos de estudio, generó una disminución en la actividad de la polifenoloxidasa, en consecuencia una lenta degradación oxidativa de los compuestos fenólicos de la fruta, esto evidenciaría un menor pardeamiento enzimático de la pulpa constatando la estrecha relación entre el cambio del color y el oscurecimiento enzimático oxidativo11, entre tanto, los tratamientos T y T , en donde se involucra la adición de soluciones independientes de ácido cítrico y quitosano respectivamente, consiguieron menores cambios del color a comparación del control (T1), pero mayor a la variación obtenida por el T4, siendo esta diferencia total de 15,12 y 18,99 para la pulpa tratada con solución de ácido cítrico y quitosano respectivamente.
Ante la actual problemática sobre la oxidación enzimática de la chirimoya, causada por la polifenoloxidasa, cuando la fruta es procesada, además de los escasos trabajos de investigación realizados para contrarrestar el fenómeno de oscurecimiento en pulpa de chirimoya, se procedió a realizar un análisis de la cinética química, donde se observa estudios relacionados con la diferencia del color en diversas frutas debido a su relación con la pérdida de la calidad sensorial; la investigación realizado por Ibarz et al.20 dejan abierta la posibilidad de aplicar la ecuación de Arrhenius en curvas o rectas que presenten un modelo cinético de primer orden u orden cero, al evaluar la rapidez del pardeamiento no enzimático a diferentes temperaturas encontraron un alto nivel de confianza (99%) con una variación lineal del color en zumos de frutas. Ante la similitud de los resultados y la elevada correlación lineal para cada una de los tratamientos, existe la probabilidad de pronosticar el tiempo de vida útil en función a los cambios de color que se produce en la pulpa durante el almacenamiento, siendo este valor un parámetro importante por ser considerado un indicador de pérdida de la calidad sensorial. La Figura 7 muestra imágenes del avance del oscurecimiento oxidativo durante las fechas de evaluación, siendo el tratamiento control el que mostró a los 100 días de almacenamiento un cambio de color (∆E = 20) en el que se consideró un pardeamiento de la pulpa, perceptible por el ojo humano, con probabilidad de rechazo por parte del consumidor.
En base a la ecuación de Arrhenius se muestra el siguiente modelo: ∆E = ∆E* + KT el cual obedece a la regla de correspondencia de la variación del color (Figura 6). Para lograr estimar la vida útil de los diferentes tratamientos se tomó, como índice final de calidad, la diferencia del color conseguido por el tratamiento control hasta el día 100 (∆E = 20), este valor fue considerado como referencia debido a la evidencia del pardeamiento en la pulpa, de tal modo, el tratamiento (T3) obtuvo una vida útil de 125 días según el modelo cinético que lo rige (∆E = 0,16 + 0,0786T), mientras el T2, una vida útil de 158 días según la ecuación que rige (∆E = 0,126 + 0,0943T), sin embargo, el tratamiento T4, con un modelo cinético de ∆E = 0,0787 + 0,0986T, lograría un tiempo de vida aproximado de 254 días en almacenamiento (-20°C), Concluyendo, en base a todos los resultados mostrados, que el tratamiento T4 retrasó el pardeamiento enzimático en la pulpa de chirimoya.
CONCLUSIONES
El quitosano, extraído a partir de la pluma de pota, empleada en la presente investigación ostenta las siguientes características fisicoquímicas: 10,52% de humedad, 0,35% de cenizas, 846 kDa de peso molecular y 78,2% del grado de desacetilación.
La chirimoya de variedad Lisa es la mejor, debido a que obtuvo un 70,07%; 3,10% y 26,31% en rendimiento adecuado de pulpa, pepa y cáscara respectivamente.
El tratamiento cuatro (T4) cuya formulación presenta quitosano al 0,75% y ácido cítrico al 3% es el mejor, porque presentó la menor variación en el contenido de polifenoles totales, actividad de la enzima polifenoloxidasa y cambios de color, registrando valores de 28 mg de ácido gálico/100 g de pulpa en fresco, 70,80 Unidades de PPO/min x g de muestra y 9,61 de variación del color respectivamente. Los estudios cinéticos proyectan un tiempo de vida útil, para el tratamiento T4, hasta 254 días en almacenamiento a -20°C.