INTRODUCCIÓN
La cinchona pertenece a la familia Rubiaceae y es originaria de la cordillera de los Andes en Sudamérica; aunque, también se puede encontrar en Indonesia, Camerún, Vietnam, la India y en otros países asiáticos y africanos (1). En el Perú, se ha reportado que el género Cinchona presenta quinina, un alcaloide con propiedades antifebrífugas, considerando a Cinchona officinalis como la especie más importante desde un punto de vista medicinal, ya que su corteza produce en promedio el 40% de alcaloides cristalizables y el 1% de sulfato de quinina (2). Los polifenoles son considerados potentes antioxidantes que pueden prevenir enfermedades asociadas al estrés oxidativo como el cáncer (4,5). La actividad antioxidante de los extractos vegetales es estimable mediante diversos métodos(4); además, se ha encontrado evidencia de que Cinchona pubescens puede ser una fuente natural de antioxidantes por los flavonoides (3). Añadido a esto, en Jordania, estudios han confirmado que la especie Cinchonaledgeriana presenta un uso tradicional como antidiabético debido a su alta actividad antioxidante. Así mismo, en la India, estudios reportaron que los extractos de la Cinchona officinalis poseen alta defensa frente al estrés oxidativo debido a la capacidad antioxidante otorgada por los compuestos fenólicos encontrados en dichos extractos.
En las últimas décadas, las infecciones fúngicas aumentan increíblemente con el género Candida como la principal causa de morbilidad y mortalidad en pacientes hospitalizados e inmunocomprometidos (8). En Colombia, Niño et al. (2017) evaluaron la actividad antifúngica de 22 plantas de la flora colombiana mediante el método de difusión en agar frente a Aspergillus fumigatus, Candida albicans y Fusarium solani utilizando ketoconazol como control positivo. Siendo una de ellas el extracto con diclorometano de Cinchona pubescens Vahl, el cual mostró actividad moderada solo frente a Candida albicans (9). En India, Shinde et al (2018), evaluaron la actividad in vitro de diferentes medicinas homeopáticas para inhibir Candida albicans siendo el estándar de Cinchona officinalis a diferentes potencias (6C, 12C, 30C, 200C, 1M), siendo la potencia 12C la que mostró mayor zona de inhibición (0,9 ± 0,42 cm) (10). La resistencia bacteriana a los medicamentos es uno de los principales problemas de salud pública a nivel mundial, ya que algunas infecciones bacterianas no responden a los tratamientos actuales y están aumentando, por lo que existe la necesidad de desarrollar nuevos antibióticos (11). Peñarreta et al. (2023) realizaron un estudio sobre la valoración de distintas especies vegetales con uso tradicional en medicina que son originarias de América del Sur, la especie que más resalto fue la Cinchona pubescens, la cual es un componente importante de la medicina tradicional en diferentes países de América Central y del Sur, se utiliza mayormente como fuente de quinina desde su descubrimiento como medicamento eficaz contra la malaria en el siglo XVII. Sin embargo, también se menciona que se sigue invesigando algunas otras actividades biológicas que puedan contener (12). En un estudio realizado en el 2020, Antika et al. examinaron la actividad antimicrobiana de los derivados de la quinina, el cual fue extraído de la corteza de Cinchona spp. y su Concentración Mínima Inhibitoria contra cepas de Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa y Bacillus subtilis mediante la prueba de difusión en disco. Los resultados fueron comparados con la estreptomicina. Se obtuvo que el propionato de quinina proporcionaba mayor actividad antimicrobiana, con un rango de inhibición de 9 a 23,5 mm en comparación de la estreptomicina con un rango de inhibición de 8 a 12 mm (13). Es de esta manera que las investigaciones antes mencionadas nos llevan a evaluar la composición química, actividad antioxidante, anti- Candida y antibacteriana in vitro del aceite esencial de las hojas de Cinchona pubescens Vahl.
PARTE EXPERIMENTAL
Colecta y tratamiento de las muestras
Las hojas de Cinchona pubescens Vahl. fueron colectadas del bosque de neblina de Upaypiteq, distrito de Cañaris, provincia de Ferreñafe, región de Lambayeque a 2800 msnm. Esto se realizó durante el mes de abril del año 2023. Las muestras fueron secadas a la exposición solar indirecta y al aire libre.
Obtención del aceite esencial
Se utilizó la técnica de arrastre por vapor de agua en un destilador semiindustrial de acero inoxidable con capacidad de 6Kg de materia vegetal seca. Se trabajó con 47.4 kg de hojas secas de Cinchona pubescens Vahl.
Determinación de la composición química
La determinación de la composición química del aceite esencial de las hojas de Cinchona pubescens Vahl. se realizó mediante el método de cromatografía líquida de alto rendimiento (HPLC). La temperatura de la columna cromatográfica fue de 25 °C. La fase móvil se formó por una mezcla de agua con ácido trifluoroacético al 0,1% y acetonitrilo. Por otro lado, su caudal fue de 0,2 mL/min. Asimismo, el volumen de inyección tuvo el valor de 5 uL (14). La identificación y asignación de picos de los componentes químicos del aceite esencial de las hojas de Cinchona pubescens Vahl. se basaron en la comparación de los tiempos de retención y los datos espectrales con los de los estándares siendo controlados a una longitud de onda de 262 nm (15).
Determinación de la actividad antioxidante in vitro por el método de captación del radical 2,2-difenil-1-picrihidrazil (DPPH•)
La solución stock se obtuvo disolviendo 2,4 mg de DPPH en 100 mL de metanol y posteriormente se dejó reposando a una temperatura de -20ºC hasta su uso. La solución de trabajo se consiguió reaccionando 10 mL de la solución stock con 45 mL de metanol hasta la obtención de una absorbancia de 1.10 (+/- 0.02) a una longitud de onda de 517 nm. Para la lectura, se tomó 20 μL de muestras que reaccionaron con 9900 μl de la solución de trabajo DPPH durante 24 horas en la oscuridad. Luego se midió la absorbancia a 517 nm. El antioxidante de referencia fue Trolox (6-hidroxi-2, 5, 7, 8- tetrametilcromo-2-ácido carboxílico 97%) y se utilizaron cinco concentraciones de Trolox (100, 250, 500, 750 y 1000 μM) a partir de un stock de Trolox 2.0 mM para 10 mL con el fin de la preparación de la curva de Trolox. Los resultados se expresaron en actividad antioxidante equivalente a μg EqTrolox/g muestra (TEAC). El valor de TEAC se calculó mediante la siguiente fórmula:
TEAC = IC 50 (Trolox µg/mL) / IC 50 (DPPH• extracto) mg/mL
El IC50 correspondió a la concentración en la que se neutraliza el 50% de los radicales libres de DPPH (17). El porcentaje de inhibición se calculó mediante la siguiente fórmula:
%Inhibición = (Abs.Control - Abs.Muestra) / (Abs.Control) x100
Determinación de la actividad antioxidante in vitro por el método de captación del radical acido 2,2’-azinobis (3-etilbezotiazolin)- 6-sulfonico (ABTS•+)
La actividad antioxidante se determinó utilizando el catión radical ácido 2,2’-azinobis (3- etilbenzotiazolin)-6-sulfónico (ABTS•+) según Re et al. (16). El ABTS se disolvió en agua a una concentración de 7 mmol/L para la obtención de la solución madre. El catión ABTS•+ se obtuvo reaccionando la solución madre de ABTS con 2,45 mmol/L de persulfato de potasio y se mantuvo en reposo sin luz a temperatura ambiente durante 16 horas antes de su uso. Luego la solución ABTS•+ se diluyó con agua destilada hasta la obtención de una absorbancia de 0.70 (+/- 0.02) a una longitud de onda de 734 nm. Las muestras se diluyeron con etanol hasta que se produzca una inhibición del 20 al 80%, en comparación con la absorbancia del blanco. Para la lectura, se tomó 980 uL de la solución ABTS•+ y 20 uL de muestra y se midió la absorbancia en el espectrofotómetro por 7 minutos consecutivos por triplicado a una longitud de onda de 734 nm. El antioxidante de referencia fue Trolox (6-hidroxi-2, 5, 7, 8-tetrametilcromo-2-ácido carboxílico 97%) y se utilizaron cinco concentraciones de Trolox (100, 250, 500, 750 y 1000 μM) a partir de un stock de Trolox 2.0 mM para 10 mL con el fin de la preparación de la curva de Trolox. Los resultados se expresaron en actividad antioxidante equivalente a μg EqTrolox/g muestra (TEAC). El TEAC se calculó mediante la siguiente fórmula:
TEAC = IC 50 (Trolox µg/mL) / IC 50 (ABTS•+ extracto) mg/mL
El IC50 correspondió a la concentración en la que se neutraliza el 50% de los radicales libres de ABTS•+. El porcentaje de inhibición se calculó mediante la siguiente fórmula:
%Inhibición = (Abs.Control - Abs.Muestra) / (Abs.Control) x100
Determinación de la actividad antioxidante in vitro por el método del poder antioxidante de reducción férrica (FRAP)
El reactivo FRAP se preparó con amortiguador de acetato al 0.3M, pH 3,6; con una solución de Tris a 10 mM (2-pyridyl)-s-triazina (TPTZ) en HCl al 40 mM; y FeCl3 al 20 mM, en una proporción 10:1:1. Seguidamente, se preparó la solución madre de 2 mg/mL de extracto, en base a ello se realizaron diluciones a partir de 12,5 μg/mL hasta 100 μg/mL. En este caso, se utilizó ácido ascórbico como estándar por lo que la curva de calibración se elaboró en base a las diluciones que van de 5 μmol/L a 25 μmol/L. Por último, se colocó en un tubo de ensayo 50μL de la muestra problema y 950μL de la solución de trabajo de FRAP, luego se agitó y se dejó en reposo en un ambiente oscuro por 15 minutos, luego se procedió a realizar la lectura de absorbancias a 593 nm (18). El porcentaje de inhibición se calculó mediante la siguiente fórmula:
% Inhibición = (Abs. FRAP- Abs.muestra) / (Abs.FRAP) ×100
Además, se midió el IC50 (concentración mínima necesaria para inhibir al 50% del FRAP) y el AAEAC (capacidad antioxidante equivalente al ácido ascórbico), el cual se midió en mg de ácido ascórbico/g de extracto.
El valor de AAEAC se calculó mediante la siguiente fórmula:
AAEAC = IC50 Ácido ascórbico μg/mL / IC50 FRAP muestra mg/mL
Cinchona pubescens Vahl.
Se evaluó la actividad anti-Candida albicans y antimicrobiana de la Cinchona pubescens Vahl (Quina), que determina si el aceite esencial de esta planta genera un efecto antimicrobiano sobre los siguientes microorganismos como: Streptococcus mutans ATCC 25175, Enterococcus faecalis ATCC 29212 y Candida albicans ATCC 10231.
Para determinar la actividad antimicrobiana se desarrolló la prueba de difusión en agar con discos (Técnica de Oliveira EC et al) (19). Para ello lo primero que se realizó fue activar las cepas mencionadas en diferentes medios de cultivos; Streptococcus mutans y Enterococcus faecalis se activó en medios de tripticasa soya agar (TSA) y Candida albicans en agar Sabouraud. Una vez activadas, se colocaron de 3 a 5 colonias de cada microorganismo en una solución de 5 mL de suero fisiológico, para la obtención de una dilución con un nivel de turbidez equivalente a 0,5 del estándar de McFarland (1-2 X 108 UFC/ mL). De cada dilución se obtuvo una alícuota de 100 μL el cual es sembrado por diseminación en un medio de agar Mueller Hinton, una vez hecho la siembra en los medios, se colocaron los discos de papel cargado con 10 μl del aceite esencial de Cinchona pubescens Vahl al 100% a nivel central de cada placa de agar. La incubación de los medios se realizó a 37°C por 48 horas, previamente los medios de agar fueron colocados dentro de un cilindro metálico donde se colocó una vela encendida (método de la vela extinguida), pasado el periodo de incubación se retiraron las placas para su lectura correspondiente.
RESULTADOS Y DISCUSIÓN
Obtención del aceite esencial
Se realizaron en total 8 extracciones por el destilador de arrastre por vapor de agua, con un total de 47.4 kg de hojas secas de Cinchona pubescens Vahl. y la obtención de 4.8 ml de aceite esencial. Las características generales del aceite se pueden apreciar en la tabla 1.
Tabla 1 Características del aceite esencial de hojas de Cinchona pubescens Vahl.
| Constantes | Valores |
|---|---|
| Rendimiento en seco | 0.01 %v/p |
| Densidad | 0.8401 g/ml |
| pH | 2.3 |
Determinación de la composición química
Tras realizar el análisis cromatográfico por HPLC se encontraron como componentes de mayor área relativa del cromatograma: fitol (36.98 %), n-Tetratetracontano (9.38 %) y heneicosano (6.69 %).
Otros compuestos se encontraron en bajas concentraciones, como son el escualeno, el cloruro de palmitoilo, el 2-metil tetracosano, 1-heptacosanol.
La composición química del aceite esencial de Cinchona pubescens Vahl. por análisis de HPLC presentó la presencia en mayor porcentaje del fitol (36.98 %), un precursor de tocoferoles y filoquinonas, n-Tetratetracontano (9.38 %) y heneicosano (6.69 %), ambos con actividad antimicrobiana documentada en otras especies vegetales como Allium chinense G. y Plumbago zeylanica L. (20, 21). La presencia de estos compuestos explica la baja actividad antioxidante en las pruebas in vitro, puesto que el componente de mayor concentración actúa exclusivamente como precursor de sustancias antioxidantes, como los tocoferoles.
Determinación de la actividad antioxidante por el método de 2, 2- difenil-1- picrilhidrazil (DPPH)
Se preparó una solución stock de DPPH al 40 % en metanol, de esta solución se tomó 3 mL y se diluyó con 42 mL de metanol presentando una absorbancia de 0,682.
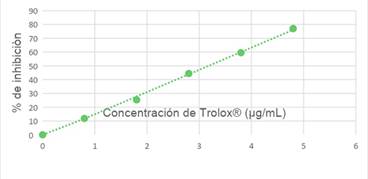
Tabla 2 Captación de radical libre DPPH de Trolox.
| Concentración del Trolox (µg/mL) | Absorbancia | Inhibición (%) DPPH | IC 50 (µg/mL) |
| 0 | 0.4581 | 0.0000 | 24.264 |
| 1,2 | 0.3379 | 262.334 | |
| 2,1 | 0.2532 | 447.242 | |
| 3 | 0.1721 | 624.218 | |
| 3,9 | 0.0845 | 815.602 | |
| 4,8 | 0.0284 | 938.000 |
Tabla 3 Captación de radical libre DPPH del ACEITE ESENCIAL.
| Concentración del aceite (mg/mL) | Absorbancia | Inhibición (%) DPPH | IC 50 (mg/mL) |
| 0 | 0.5223 | 0 | 273.029 |
| 59.96 | 0.4523 | 134.014 | |
| 132.4 | 0.3950 | 243.778 | |
| 215.62 | 0.3160 | 395.022 |
TEAC = 0.0089mg Trolox/g muestra
Para el método de actividad antioxidante mediante la captación del radical libre 2, 2- difenil-1-picrilhidrazil (DPPH), el aceite esencial de hojas de Cinchona pubescens Vahl. presenta un TEAC de 0.0089mg Trolox/g muestra, lo que se expresa como una actividad antioxidante muy baja.
Determinación de la actividad antioxidante por el método de β, β’- azinobis-(3 etilbenzotiazolin-6-sulfónico) (ABTS●+)
Se preparó una solución stock de ABTS al 2,45 mM en metanol, de esta solución se tomó 600 uL, y se diluyó con 36 mL de metanol presentando una absorbancia de 0,718.
Tabla 4 Captación de radical libre ABTS de Trolox.
| Concentración del Trolox (µg/mL) | Absorbancia | Inhibición (%) ABTS•+ | IC 50 (µg/mL) |
| 0 | 0.6757 | 0.683 | 3.1793 |
| 0.8 | 0.5853 | 0.614 | |
| 1.8 | 0.5091 | 0.5061 | |
| 2.8 | 0.3808 | 0.3802 | |
| 3.8 | 0.2834 | 0.2673 | |
| 4.8 | 0.1637 | 0.1647 |
Tabla 5 Captación de radical libre ABTS del aceite esencial.
| Concentración del aceite (mg/mL) | Absorbancia | Inhibición (%) ABTS•+ | IC 50 (mg/mL) |
| 0 | 0.6423 | 0 | 12.801 |
| 0.312 | 0.6190 | 36.326 | |
| 0.415 | 0.5680 | 115.724 | |
| 0.52 | 0.4860 | 243.383 |
TEAC = 3.5584mg Trolox/g muestra
Para el método de actividad antioxidante por el método de captación del radical catiónico de β, β’- azinobis-(3 etilbenzotiazolin-6-sulfónico) (ABTS●+), el aceite esencial de hojas de Cinchona pubescens Vahl. presenta un TEAC de 3.5584mg Trolox/g muestra, lo que se expresa como una actividad antioxidante muy baja. Sin embargo, se resalta que este valor es mayor en comparación con el TEAC por el método de DPPH●+.
Determinación de la actividad antioxidante in vitro por el método FRAP
Se colocó en un tubo de ensayo 50μL de la muestra problema y 950μL de la solución de trabajo de FRAP, luego se procedió a realizar la lectura de absorbancias a 593 nm (18). Además, se midió el IC50 (concentración mínima necesaria para inhibir al 50% del FRAP) y el AAEAC (capacidad antioxidante equivalente al ácido ascórbico) en mg de ácido ascórbico/g de extracto.
Tabla 6 Poder reductor Férrico del estándar ácido ascórbico.
| Concentración (umol/L) | Absorbancia (A) |
| 5 | 0.0307 |
| 10 | 0.1537 |
| 15 | 0.3200 |
| 20 | 0.4250 |
| 25 | 0.5453 |
Tabla 7 Poder reductor férrico del aceite esencial.
| Concentración (mg/ml) | Absorbancia (Abs) |
| 8.994 | 0.048 |
| 19.86 | 0.391 |
Para el método de actividad antioxidante mediante el poder antioxidante reductor del hierro (FRAP), el aceite esencial de hojas de Cinchona pubescens Vahl. presenta un TEAC de 1.622 mg AA/g muestra, lo que se expresa como una actividad antioxidante muy baja.
La actividad antioxidante según el método DPPH determinó que su IC50 fue de 273.029 mg/mL, un dato muy alejado en comparación a su estándar (Trolox) el cual su IC50 fue de 2.4264 ug/mL. Un resultado similar fue alcanzado a través del método ABTS, donde el IC50 fue de 1.2801 mg/mL, mientras que para el estándar se encontró un IC50 de 3.1793 ug/mL. En el ensayo de FRAP se determinó un poder reductor de hierro equivalente a 1.622 mg AA/ g aceite. Estos tres resultados demuestran la baja actividad antioxidante encontrada en el aceite esencial extraído de las hojas de esta especie de Cinchona, explicada por la ausencia de fitoquímicos con este tipo de propiedades.
Determinación de la actividad antimicrobiana y anti-Candida albicans del aceite esencial de las hojas de Cinchona pubescens Vahl.
Los resultados de la lectura indicaron la ausencia de halos de inhibición para las diferentes placas donde se enfrentaron los diferentes microorganismos con la Cinchona pubescens Vahl., el cual indicaría un nivel de sensibilidad nula de los microorganismos hacia el aceite esencial de quina (Figura 1) según la escala de Duraffourd (3).

Figura 9 Antibiograma de las cepas Streptococcus mutans, Enterococcus feacalis y Candida albicans frente al aceite esencial de Cinchona pubescens Vahl.
En relación a la actividad antimicrobiana del aceite esencial de Cinchona pubescens Vahl., esta no presento actividad sobre los tres microorganismo enfrentados; Streptococcus mutans, Enterococcus feacalis y Candida albicans, Estudios como el de Rojas et al. Determinaron que el extracto alcohólico de Cinchona officinalis tuvo efecto antimicrobiano sobre Sthaphylococcus aureus, Bacillus cereus, Streptococcus β hemolyticus, Pseudomona aeruginosa y Candida albicans. No presentando efecto sobre Eschericha coli. Si bien es cierto que el efecto sobre Candida es contradictorio con los resultados del estudio, se tiene que indicar que el producto que utilizamos en la prueba es distinto, en la investigación se usó un aceite esencial. así también en el mismo estudio de Rojas et al. al probar el extracto acuoso de la Cinchona officinalis, esta no genera ningún efecto antimicrobiano sobre los diferentes microorganismos mencionados en su estudio, esto indicaría que el uso del alcohol para la maceración de la planta podría ser un factor que generaría una mayor liberación de los principios activos antimicrobianos de la planta, que en este caso podrían ser los alcaloides u otros (22). Además, estudios como el de Antika et al., indican que un derivado de la quina, el éster propionato de quinina a la concentración del 5% del extracto tiene un efecto sobre E. coli. P. aeruginosa y Bacillus subtilis, no presentando efecto sobre S. aureus (23). Ramić et al., determino que derivados de la Cinchona; cinchonina y la cinchonidina presentaron actividad antimicrobiana sobre bacterias Gram positiva y Gram negativas (24). En el mismo sentido Reza et al., menciona en su revisión que derivados de Cinchona (Quinina y otros) tienen efectos antibacterianos, antiviral y antifúngicos, resaltando su efecto antibacteriano sobre
S. aureus, Streptococcus neumoniae, P. aeruginosa y E. coli, indicando que derivados de la quinina inhibirían la síntesis del ADN por derivados de la quinolina que generaría la muerte bacteriana a medida que se fragmenta el ADN girasa. Así también en relación con su actividad antifúngica contra C. albicans esta se daría por una quinolina que generaría cambios en la permeabilidad de su membrana y perdida del potencial de la membrana mitocondrial (25). Los autores antes mencionados enfatizan alguna actividad antimicrobiana de la Cinchona, pero evaluando productos derivado de la planta, en el estudio realizado se utilizó un aceite esencial de Cinchona, un producto total, diferente a un extracto u otros derivados, que no presento una actividad antimicrobiana con los microorganismos enfrentados, tal vez la preparación de extractos alcohólicos con la corteza de la planta o de compuestos químicos derivados de la planta serían la mejor opción para evaluar su actividad antimicrobiana.
CONCLUSIONES
La composición química del aceite esencial extraído de las hojas de Cinchona pubescens Vahl. realizada mediante un análisis HPLC detectó la presencia en mayor porcentaje del fitol (36,98 %), n-Tetratetracontano (9,38 %) y heneicosano (6,69 %). Además, el aceite esencial extraído de las hojas de Cinchona pubescens no presenta actividad antioxidante de importancia por los métodos DPPH, ABTS y FRAP; del mismo modo en que no presenta actividad antimicrobiana ni anti-Candida albicans contra los microorganismos estudiados como son S. mutans, E. faecalis y C. albicans. De este modo, se observa que la especie estudiada presenta componentes antimicrobianos y antioxidantes no volátiles, que pueden ser extraídos con solventes líquidos, mas no forman parte de su aceite esencial.