1. Introducción
Phytophthora capsici Leonian es un oomiceto reportado por primera vez por Leonian (1922) en plantas de pimiento (Capsicum annuum), que puede causar diversas enfermedades como pudrición de raíz, cuello, tallo y fruto, y tizón foliar en diferentes especies de Capsicum, y diversas Cucurbitáceas, Solanáceas (Lamour et al., 2012; Reis et al., 2018; Saltos et al., 2021; 2022), Fabáceas y Rosáceas, totalizando 49 familias botánicas (Lamour et al., 2012; Barboza et al., 2017; Reis et al., 2018; Abeysekara et al., 2019). La alta dispersión policíclica del fitopatógeno (P. capsici completa más de un ciclo de vida en tejidos aéreos como hojas y frutos), y la reducida disponibilidad de genotipos resistentes y diversidad de oomiceticidas (fungicidas) efectivos, hacen que el oomiceto sea considerado uno de los fitopatógenos transmitidos por el suelo más destructivos a nivel mundial (Moreira-Morrillo et al., 2022).
El control de las enfermedades causadas por P. capsici no solo en hortalizas, generalmente es realizado mediante la aplicación de oomiceticidas (Saltos et al., 2022). Estos insumos generan efectos negativos al ecosistema como persistencia ambiental de residuos tóxicos y contaminación al suelo y agua, e incluso su uso indebido o excesivo puede inducir reducción de sensibilidad en el oomiceto a las distintas moléculas comerciales (Chemeltori et al., 2017; Izzeddin & Medina, 2011). Por otro lado, actualmente el aumento constante de la población mundial y los daños producidos por el cambio climático, hacen que necesitemos obtener rendimientos altos y de calidad, pero mediante el uso de estrategias sostenibles y eficientes (Poveda, 2021). A fin de reducir el uso de moléculas sintéticas en el control de enfermedades causadas por P. capsici, es necesario usar otras alternativas que generen y promuevan la sustentabilidad ecológica, como la aplicación de microorganismos i.e. Bacillus sp., Pseudomonas spp., Streptomyces spp., Trichoderma spp., entre otros (Chemeltorit, et al., 2017; Shafi, et al., 2017; Zohara et al., 2016; Lahlali et al., 2022). Parece ser que muchos de estos microrganismos que también controlan insectos plaga, tanto directa como indirectamente (Poveda, 2021; Dimkić et al., 2022), representan la mayoría de la microbiota encontrada e identificada en la rizósfera, y comúnmente utilizados en el control biológico de enfermedades causadas principalmente por fitopatógenos (Lahlali et al., 2022).
El uso de microorganismos benéficos como biocontroladores podría ser una buena alternativa para producir ají o pimiento de forma más ecológica y económica. El antagonismo directo de enfermedades potenciales a través de la producción de biopesticidas es una de las características de los microorganismos que contribuyen a la salud de las plantas (Jayaraman et al., 2021; Lahlali et al., 2022). Es conocido que los biocontroladores generan un aumento en la germinación de semillas, longitud y masa de raíces, y brotes en plantas de Capsicum y otros géneros (Lee et al, 2008; Tančić-Živanov, 2020; Zhang et al., 2016). Otro de los efectos producidos por estos microorganismos o algunos de sus compuestos o moléculas en varias especies vegetales, es la inducción de resistencia. Normalmente P. capsici infecta, coloniza y se reproduce de forma rápida y eficiente en tejidos de huéspedes susceptibles de Capsicum (mayoría de genotipos comerciales), pero contrariamente en genotipos resistentes estos procesos son retrasados o no suceden debido una respuesta de defensa física, bioquímica y molecular contra P. capsici (Gaibor-Vaca et al., 2022).
Muchos de los mecanismos de defensa también podrían ser activados por la aplicación de biocontroladores en genotipos susceptibles (Pieterse et al., 2014). Por ejemplo, algunos volátiles microbianos emitidos por diferentes microorganismos en la rizosfera aparte de correlacionarse con volátiles emitidos por plantas actúan como moléculas de señalización que desencadenan vías metabólicas y reguladores transcripcionales (Thankappan et al., 2022). De la misma manera, Bacillus y otros microorganismos pueden activar positivamente la vía de inmunidad desencadenada por patrones moleculares asociados a patógenos en Arabidopsis thaliana (Zhang et al., 2016). Así, en la presente revisión se ha abordado no solo una descripción general actualizada de la actividad antimicrobiana de Bacillus, Pseudomonas, Streptomyces y Trichoderma asociados a plantas principalmente de Capsicum, y que están involucradas en la supresión de enfermedades causadas por P. capsici, sino también lo referente a la interacción entre estos agentes biocontroladores y P. capsici en plan tas de Capsicum, tanto a nivel bioquímico como molecular.
2. Phytophthora capsici
Descripción del patógeno
Phytophthora capsici pertenece al Reino Cromista (Stramenipila), Phylum Oomycota, Clase Peronosporea, Orden Peronosporales y Familia Peronosporaceae (Figura 1; Roskov et al., 2016; Amrani & Abdel-Azeem, 2018). Este microorganismo que crece en medio de cultivo (Figura 1A), posee micelio cenocítico, es una especie heterotálica, y tiene dos tipos de apareamiento (designados A1 y A2), pero que requieren de ambos tipos en las proximidades para que ocurra el coito (Lamour et al., 2012). Siendo así, P. capsici produce un gametangio masculino (anteridio) y otro femenino (oogonio), que después de entrar en contacto se produce la meiosis, seguido de la plasmogamia y la cariogamia resultando en la formación de oosporas (Figura 1B; esporas sexuales). Estas estructuras varían entre 15 y 40 µm, y pueden germinar después de un período de reposo (Erwin & Ribeiro, 1996).
En condiciones ambientales favorables, P. capsici a menudo produce cantidades masivas de esporangios en la superficie del tejido infectado (Lamour et al. 2012), pero estas también pueden ser inducidas en condiciones in vitro en medio de cultivo Agar V8 (Figura 1C). Dichas estructuras pueden ser ovoides, elipsoides y papilados, conteniendo zoosporas reniformes y biflageladas en su interior (Jung et al., 2003), las mismas que son liberadas rápidamente, aisladas o agrupadas, cuando están sujetas a choques térmicos (Ortíz & Camargo, 2005). El oomiceto rara vez produce clamidosporas (esporas de resistencia), siendo estas tanto intercalares (formados entre hifas) como terminales (al final de la hifa) con un tamaño que varía entre 20,0 y 27,5 µm de diámetro (Islam et al., 2005).
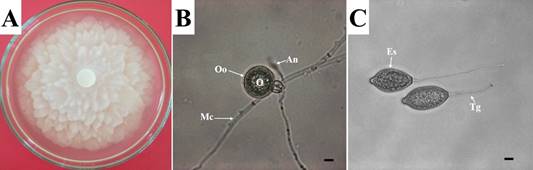
Figura 1 Características de Phytophthora capsici. A) Crecimiento del oomiceto sobre una caja de Petri conteniendo medio de cultivo. B) Micelio cenocítico (Mc), y anteridio (An; gametangio masculino), oogonio (Oo; gametangio femenino) y oospora (O; espora sexual). C) Esporangio (Es) produciendo tubo germinativo (Tg). Barras (A-B): 10 µm. (Imágenes cedidas por Ailton Reis).
Síntomas asociados a Phytophthora capsici en ajíes y pimientos
P. capsici puede causar (Figura 2) desde pudrición de semillas hasta tizón foliar, y en pre y post-emergencia produce pudrición y marchitamiento en plántulas (damping-off), pudiendo incluso observarse un micelio blanquecino en hipocótilos (Gevens et al., 2011). En la fase de crecimiento, las plántulas pueden mostrar pudrición de raíz y de cuello (Figura 2A), marchitez (Figura 2B-C), enanismo, formación de cancros y tizón foliar (Figura 2D; Quesada-Ocampo, 2010; Granke et al., 2012; Saltos et al., 2021; 2022). En plantas adultas puede obser varse marchitez (Figura 2E), y principalmente pudrición en raíces, tallos y frutos (Figura 2F: Gevens et al., 2011; Lamour et al. 2012; Moreira-Morrillo et al., 2022). En este último tejido se genera una reducción en su calidad y cantidad.
Otros síntomas producidos por P. capsici son amarillamiento y marchitez repentina de hojas, resultado de la colonización de tejidos por el patógeno (Ristaino & Johnston, 1999; Saltos et al., 2021; Moreira-Morrillo et al., 2022). P. capsici puede aparecer en cualquier etapa fenológica de la planta, y sus síntomas pueden variar según el órgano afectado, condiciones ambientales y la especie hospedante (Baysal et al., 2005). Sin embargo, una vez que el patógeno ingresa a la planta sea a través de heridas o aberturas naturales, los síntomas aparecen a los 5 o 7 días después de la infección (Lamour et al. 2012; Saltos et al., 2021). De forma general, los síntomas producidos por el oomiceto en hortalizas pueden ser semejantes entre sí, i.e. pudrición de raíces, hipocótilos y frutos, tizón foliar y marchitamiento (Gevens et al., 2011; Lamour et al. 2012; Saltos et al., 2021; 2022).

Figura 2 Síntomas producidos por Phytophthora capsici en plántulas y plantas adultas de pimiento (Capsicum annuum) en condiciones experimentales (A, B, C, D y F) y de campo (E). Pudrición de raíz y de cuello (A), marchitez tenue (B) e intensa (C) en plántulas. Tizón foliar (D) y marchitez (E) en plantas adultas en condiciones experimentales y de campo, respectivamente. Pudrición en frutos (F).
3. Uso indiscriminado de oomiceticidas
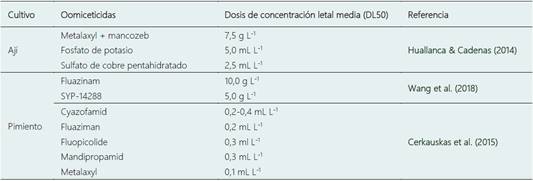
Existen una variedad de oomiceticidas disponibles en el mercado que pueden ser usados para manejar las diferentes enfermedades causadas por P. capsici (Tabla 1). Sin embargo, el uso de estas moléculas en hortalizas puede tornarse a largo plazo un problema, por ejemplo, ocasionar la pérdida de sensibilidad del patógeno a las moléculas comerciales disponibles en el mercado (Huallanca & Cadenas, 2014; Wang et al., 2018). De hecho, actualmente se conoce que el uso de Metalaxyl + mancozeb (7,50 g L-1), Fluazinam (10 g L-1) y SYP-14288 (5 g L-1) en el manejo de P. capsici se está volviendo un problema, siendo necesario aumentar la dosis recomendada. Como resultado, existe evidencia de la presencia de mutaciones asociadas a fenotipos de este oomiceto resistentes a algunas moléculas (Tabla 1) (Pang et al., 2013; Miao et al., 2016; Wang et al., 2018).
4. Control biológico de enfermedades causadas por Phytophthora capsici
Como se comentó anteriormente, el uso creciente de pesticidas, junto con la contaminación del suelo y el agua, ha llevado a investigadores a buscar alternativas rentables y respetuosas con el medio ambiente para controlar enfermedades transmitidas por el suelo, que son muy difíciles de manejar y que limitan significativamente la producción agrícola a nivel mundial (Jayaraman et al., 2021). Así, los agentes de control biológico pueden ser herramientas viables en el manejo de enfermedades causadas por fitopatógenos vehiculados por el suelo (Diánez et al., 2015), e incluso de varios insectos plaga (Poveda, 2021; Dimkić et al., 2022). Entre los agentes de biocontrol más utilizados están algunas especies de Bacillus, Pseudomonas, Streptomyces y Trichoderma, representando también la mayoría de los microorganismos comúnmente encontrados en la rizósfera (Lahlali et al., 2022). Generalmente muchos de estos organismos actúan a través de diferentes modos de acción, como antibiosis, hiperparasitismo, degradación de las paredes celulares de los patógenos, competencia por nutrientes en la rizósfera, y su posterior colonización, depredación y resistencia inducida en plantas contra P. capsici (Pal, & Gardener, 2006; Köhl et al., 2019; Tomah et al., 2020; Jayaraman et al., 2021; Dimkić et al., 2022; Tyśkiewicz et al., 2022).
Otro punto importante con respecto al uso de microorganismos en plantas es el efecto ejercido por estos en la microbiota del suelo, así como en la de tejidos vegetales. En pimiento, se conoce que independientemente de la respuesta del genotipo (resistente o susceptible) y del tejido infectado o no por P. capsici, la micobiota localizada en hipocótilos no es afectada por el oomiceto (Garcés-Fiallos et al., 2022). Sin embargo, en un trabajo reciente realizado por Abbasi et al. (2021), analizando la respuesta de las comunidades bacterianas de la rizosfera en plantas de pimienta negra inoculadas con P. capsici, y posteriormente tratadas con el biocontrolador Streptomyces, parece que la modulación es distinta de la composición del bacterioma en plantas infectadas. Por ejemplo, los géneros Devosia, Promicromonospora, Kribbella, Microbacterium, Amylocolatopsis y Pseudomonas respondieron posi tivamente contra el oomiceto en la rizósfera. Además, las interacciones positivas encontradas al comparar perfiles de comunidades bacterianas entre tratamientos pueden a futuro permitir diseñar bioinoculantes sintéticos para resolver problemas agronómicos de manera ecológica.
Otro punto o término a tener en cuenta es la supresividad del suelo, o simplemente hablar de “suelos supresivos”, término usado muy poco en idioma español. La supresión de enfermedades del suelo es la reducción de la incidencia de enfermedades transmitidas por el suelo incluso en presencia del huésped y de la fuente de inóculo en el suelo (Jayaraman et al., 2021). Pudiendo decirse también, que es la capacidad del suelo de no dejar establecer o persistir un fitopatógeno como P. capsici, o reducir la intensidad de las enfermedades producidas por el oomiceto en un suelo infestado. Por ejemplo, normalmente estos suelos pueden encontrarse en agrosistemas orgánicos, donde se puede observar una reducción del tizón foliar ocasionado por P. capsici en pimiento, y una diversidad bacteriana de Bacillus y otros géneros bacterianos, en comparación con los de sistemas de cultivo integrado o convencional (Li et al., 2019). Incluso la eficiencia de abonos orgánicos en la supresión de enfermedades se puede mejorar con la aplicación de biocontroladores como B. subtilis y T. hamatum (Hadar & Papadopoulou 2012). Así, se ha encontrado que esta supresión de enfermedades se atribuye principalmente a la diversidad microbiana presente en un suelo.
Tabla 1 Respuesta de aislados de Phytophthora capsici obtenidos a partir de tejidos de ají y pimiento a diferentes oomiceticidas
Aunque dicha técnica sea una opción prometedora, aún requiere de una mayor comprensión de la complejidad de las interacciones bioquímicas y ecológicas entre el huésped y los patógenos (Jayaraman et al., 2021). Sin embargo, hay que tener en cuenta que factores abióticos, especie vegetal, cantidad de materia orgánica y medidas culturales i.e. labranza, fertilización o enmiendas (orgánica e inorgánica), aplicación de pesticidas de distinto origen, y riego, podrían estar alterando significativamente la capacidad fisicoquímica del suelo, afectando de una u otra manera el crecimiento vegetal y la diversidad microbiana, y la supresividad del suelo contra los fitopatógenos.
A continuación, se presentan algunas investigaciones relacionadas al efecto ejercido por Bacillus, Pseudomonas, Streptomyces y Trichoderma en plantas de Capsicum infectadas o no con P. capsici. Hay que recalcar que, aunque pocas, algunas referencias corresponden a otros cultivos.
Bacillus spp.
Bacillus es un género bacteriano encontrado asociado a raíces, contribuyendo a la protección de plantas mediante la interferencia directa del crecimiento de fitopatógenos o estimulación de la resistencia sistémica en el huésped (Figura 3), e incluso interactuando constantemente con otros microbios a través de diferentes tipos de comunicación (Andrić et al., 2020). Las especies pertenecientes al género Bacillus comúnmente son consideradas ideales debido a su rápido crecimiento, facilidad de manejo y ex celentes propiedades colonizadoras (Dimkić et al., 2022). La eficacia de estos bacilos en la protección de plantas, así como su presencia constante en el nicho rizosférico fuertemente competitivo, se deben a su valioso potencial para sintetizar una amplia gama de compuestos orgáni cos volátiles (COV) y metabolitos secundarios bioactivos (BSM) solubles (Andrić et al., 2020; Dimkić et al., 2022). De hecho, estas bacterias pueden producir sustancias antimicrobianas como péptidos de síntesis ribosomal, policétidos (PK) o lipopéptidos (NRPs), que inducen mecanismos de defensa en plantas (Figura 4; Fickers et al., 2012).
En los últimos años se ha aclarado la filogenia de varias especies de Bacillus, que incluyen B. amyloliquefaciens, B. atrophaeus, B. licheniformis, B. pumilus, y B. siamensis, B. subtilis ssp. subtilis y B. velezensis, con potencial biocontrolador por la producción de BSM, sin embargo, esto parece depender de la especie. Efectivamente, todas estas especies de bacilos pueden producir sustancias surfactantes y bacilibactina (dépsido), pero B. velezensis es la única que puede producir macrolactina (policétido), y esto se repite con otros BSM (Andrić et al., 2020). De cualquier manera, varios de estos compuestos como NRPs parecen poseer actividad antimicrobiana contra P. capsici (Park et al., 2016; Pedraza et al., 2020).
En ensayos in vitro, Bacillus spp. y algunos de sus extractos pueden reducir el crecimiento de P. capsici en hasta un 70% (Bhusal & Mmbaga, 2020; Li et al., 2019; 2020; Syed-Ab-Rahman et al., 2021). B. licheniformis puede inducir ramificación excesiva y lisis significativa en hifas, así como reducción del desarrollo de esporangios y motilidad de zoosporas de P. capsici (Li et al., 2020). B. amyloliquefaciens y B. thuringiensis inhiben la germinación de zoosporas de P. capsici en más del 90 % (Ley-López et al., 2018). Por otro lado, extractos de lipopéptidos producidos por B. amyloliquefaciens pueden inhibir la germinación total de zoosporas de P. capsici, encontrándose malformaciones del tubo germinativo y degradación celular (Ley-López et al., 2022). Esta capacidad de Bacillus para inhibir la germinación de zoosporas y el crecimiento del tubo germinativo en los tejidos del huésped, posiblemente influye en la reducción efectiva de la intensidad del tizón foliar causada por P. capsici en pimiento (Li et al., 2020). Este potencial antagónico de Bacillus contra el patógeno (Li et al., 2019;2020), puede estar relacionada a la producción de varios compuestos lipopeptídicos como la iturina, la surfactina y la fengicina por parte de las bacterias, y que están activos en muchas plantas (Syed-Ab-Rahman et al., 2021; Dimkić et al., 2022).
En condiciones in vivo, especies como B. licheniformis reduce efectivamente la severidad de la pudrición de raíz y tallo (Ley-López et al., 2018) y del tizón foliar, ambas causadas por P. capsici en ají, pimiento y tomate (Hyder et al., 2020; Li et al., 2020). Se ha encontrado incluso que B. vallismortis o B. amyloliquefaciens pueden llegar a ser significativamente superiores al uso oomiceticidas como el metalaxil, cuando de manejo de P. capsici se trata (Bhusal & Mmbaga, 2020). A parte de este efecto en el oomiceto, Bacillus también induce un aumento de longitud de raíces, altura de planta, peso de brotes, y contenido de clorofila (Figura 3) (Bhusal & Mmbaga, 2020; Li et al., 2020). Algo semejante se ha observado en plantas de jitomate (Lycopersicon esculentum Mill.), donde la aplicación de B. firmus puede reducir e inhibir el crecimiento micelial de P. capsici, pero también estimular la germinación de semillas, e incrementar el volumen radicular y el peso seco de hojas (Figura 3; Lagunas et al., 2001). También, B. amyloliquefaciens y B. velezensis puede promover el crecimiento de plantas pimiento y sus propiedades anti oomiceto contra Phytophthora (Figura 3; Syed-Ab-Rahman et al., 2021). La supresión de enferme dades y la promoción del crecimiento vegetal en varios cultivos hacen que varias especies de Bacillus y otras bac terias sean clasificadas como rizobacterias promo toras del crecimiento vegetal (PGPR; Hyder et al., 2020).
Diversas bacterias, incluida Bacillus, sintetizan una amplia gama de COV y BSM, propiciando la presencia constante de que estos biocontroladores en el nicho rizosférico fuertemente competitivo (Fickers et al., 2012; Andrić et al., 2020), en especial en suelos infestados con aislamientos altamente virulentos de P. capsici (Hyder et al., 2020). Algunos bacilos pueden producir cianuro de hidrógeno (HCN), catalasa, ácido indol-3-acético (IAA; entre 6,10 y 56,23 µg mL−1), así como sideróforos (Figura 4; Hyder et al., 2020). Estos agentes antimicrobianos se pueden agrupar en enzimas, proteínas tales como polipéptidos y compuestos no proteicos (Syed-Ab-Rahman et al., 2021). Incluso, algunos extractos crudos de Bacillus fraccionados mediante cromatografía de capa fina han mostrado ser equivalentes a la aplicación de aislados bacterianos vivos, siendo ricos en pirrolopirazina, dicetopiperazina (DKP) y compuestos fenólicos (Syed-Ab-Rahman et al., 2021).
De manera general, los metabolitos secundarios producidos por Bacillus u otras bacterias estarían involucrados en los mecanismos de biocontrol, biofertilización e inducción de resistencia sistémica en plantas, a través de la producción de sustancias volátiles que incluyen alcoholes, aldehídos, compuestos aromáticos, sulfuros y cetonas. Por ejemplo, lipopéptidos, policétidos y volátiles de Bacillus spp. puede estimular la expresión de genes que codifican proteínas relacionadas con la patogénesis (PR), y otras proteínas relacionadas con la defensa en las plantas hospedantes a través de la activación de las vías de señalización del ácido jasmónico (JA), ácido salicílico (SA) o etileno (ET) (Dimkić et al., 2022). Por ejemplo, B. subtilis aplicado preventivamente en intervalos de tiempo, puede brindar protección a plantas de pimienta negra contra la infección por P. capsici, mediante el aumento de la actividad enzimática de quitinasa, peroxidasa, fenilala nina amonio liasa, polifenol oxidasa, β-1,3-glucanasa y del contenido de fenoles (Shobha et al., 2019). Al gunos biocontroladores pueden proteger las plantas de fitopatógenos a través de una inducción de resistencia, o contra las infecciones en una interacción antagónica directa con el patógeno (Pieterse et al., 2014; Syed-Ab-Rahman et al., 2019).
Pseudomonas spp.
El género Pseudomonas es rico en especies con potencial biocontrolador con efectos positivos sobre la salud de las plantas, que participan activamente en interacciones complejas planta-patógeno-antagonista (Dimkić et al., 2022), donde se incluye el género Phytophthora (Zohara et al., 2016). La aplicación de especies como P. aeruginosa, P. fluorescens, P. libanensis y P. putida pueden inhibir sinérgicamente entre el 50 y 70% del crecimiento in vitro de P. capsici (Lee et al., 2003; Ramírez et al., 2015; Chemeltori et al., 2017; Khatun et al., 2018). Algunas cepas de P. aeruginosa pueden también inhibir significativamente el crecimiento de hifas de P. capsici mediante la inducción de ramificación excesiva, hinchazón y desintegración celular (Zohara et al., 2016), e incluso perjudicar la motilidad total y provocar lisis en hasta la mitad de zoosporas (Khatun et al., 2018). A su vez, tanto células vivas como los sobrenadantes de P. aeruginosa pueden suprimir significativamente la formación de esporangios, la libera ción de zoosporas y el crecimiento del micelio en cultivo líquido, así como la dilución de estas en 5 y 10 veces cau sando lisis e inmovilizando las zoosporas, respectiva mente, en un período muy corto de tiempo (Zohara et al., 2016).
En experimentos in vivo, algunas especies como P. putida, P. libanensis y P. aeruginosa pueden mejorar la germinación de semillas y crecimiento en plantas de pepino, pimiento (Khatun et al., 2018; Hyder et al., 2020). Así mismo, en tratamiento de semillas de ají con T. hamatum y P. aeruginosa y establecidas en un suelo infestado con zoosporas de P. capsici, no aumenta la germinación de semillas ni el crecimiento de plántulas, pero sí reduce significativamente la incidencia de pudrición del cuello y el marchitamiento de las plántulas y el área bajo la curva de progreso de la enfermedad, tanto con uno o ambos organismos en comparación al testigo (Chemeltori et al., 2017). Incluso esa actividad de inhibición de este tratamiento duplo (T. hamatum + P. aeruginosa) puede incluso equipararse al tratamiento de mefenoxam, lo que implicaría una alternativa eficaz y sostenible para el tratamiento de semillas de ají. Las ventajas del uso de Pseudomonas también han sido demostradas en pimiento dulce bajo un sistema hidropónico bajo condiciones controladas por Gilardi et al. (2021). Ellos verificaron que la mezcla de las cepas Pseudomonas sp.FC 7B, Pseudomonas sp. FC 9B y P. putida FC 8B aplicados de forma preventiva, reduce la incidencia de pudrición de raíz y cuello causada por P. capsici, aumenta el peso fresco de las plantas, con resultados similares o mejores que los de una mezcla comercial de T. asperellum + T. gamsii (Figura 3; Gilardi et al., 2021).
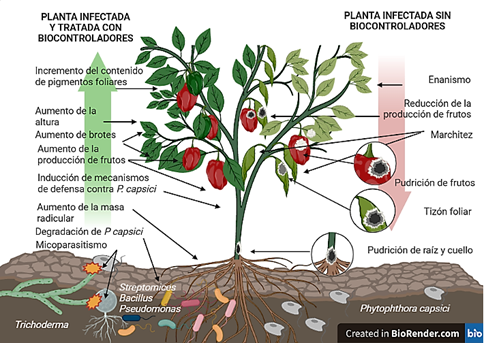
Figura 3 Efecto de biocontroladores (Bacillus, Pseudomonas, Streptomyces y Trichoderma) en plantas de Capsicum infectadas por Phytophthora capsici. Estos microorganismos afectan negativamente al oomiceto localizado en el sustrato, y positivamente a la planta, induciendo algunos de sus mecanismos de defensa, lo que reduciría la intensidad de cada una de las enfermedades causadas por P. capsici (lado izquierdo de la Figura). Sin los biocontroladores, el oomiceto causaría un sinnúmero de síntomas, que posteriormente ocasionaría incluso la muerte de la planta (lado derecho de la Figura).
Parece ser que en condiciones in vivo, independientemente del tipo de aplicación en las plantas, el tratamiento con Pseudomonas parece inducir una mayor resistencia al marchitamiento y el tizón foliar causado por P. capsici (Figura 3; Özyilmaz & Benlioglu, 2013; Zohara et al., 2016). También se ha observado que los tratamientos bacterianos combinados con aceite de oliva (5 mL por planta) mejoran significativamente la actividad biológica controladora, resultando en una reducción del 57% al 81% del tizón foliar causado por P. capsici, demostrando que cepas como P. fluorescens tienen la capacidad de producción de biosurfactantes (Özyilmaz & Benlioglu, 2013). En algunos casos, el tratamiento de plantas con Pseudomonas aparte de controlar el desarrollo de enfermedades como antracnosis (Colletotrichum orbiculare) y las causadas por Phytophthora, su eficacia puede ser casi equiparado con el de los fungicidas comerciales metalaxil y clorotalonil (Lee et al., 2003). Sin embargo, puede darse el caso que especies como P. fluorescens puedan afectar negativamente a P. caspici en pruebas in vitro, pero no consigan reducir la severidad de la pudrición de cuello y marchitez ambas causadas también por el oomiceto, ni aumentar el peso fresco de hojas en plantas de pimiento (Ramírez et al., 2015). De cualquier manera, de forma general la apli cación de Pseudomonas en diferentes especies vegetales en condiciones de invernadero o de campo sí presenta buenos resultados.
Tal vez uno de los trabajos más importantes y completos a nivel de campo, ha sido el realizado por Sang et al. (2013). Los autores realizaron una selección secuencial de cepas bacterianas antagónicas entre 239 cepas, contra el tizón foliar y antracnosis causadas por P. capsici y Colletotrichum acutatum, respectivamente, y el rendimiento de frutos en plantas de pimiento en casa plástica (dos años) y en condiciones de campo (tres años). Tanto P. otitidis y P. putida redujeron significativamente la incidencia de antracnosis en casa plástica únicamente en al menos uno de los años. Ambas especies bacterianas redujeron significativamente el tizón foliar sin influir en las poblaciones microbianas de la rizósfera, siendo incluso semejante o superior al efecto otorgado por metalaxil en condiciones de campo solo durante dos años. Además, las cepas indujeron un aumento del peso de frutos rojos y número de frutos de pimiento en ambas condiciones experimentales.
Otro de los puntos importantes es la producción de inhibidores volátiles y no volátiles producidos por Pseudomonas spp., que afectan negativamente las diferentes etapas del ciclo de vida de P. capsici, lo que evitaría eficazmente su crecimiento y proliferación, especialmente en todas las estaciones de crecimiento vegetal, y en la estación lluviosa para cuidar la propagación del patógeno mediada por zoosporas (Paul & Sarma, 2006). El potencial de transducción de los volátiles como soluciones de control biológico es un criterio necesario para la agricultura orgánica sostenible (Thankappan et al., 2022). De hecho, los metabolitos secundarios producidos por Pseudomonas u otras bacterias pueden estar involucrados en los mecanismos de biocontrol y biofertilización (Dimkić et al., 2022). Aunque existen un sinnúmero de moléculas involucradas en interacciones complejas planta-patógeno-antagonista como lipopéptidos cíclicos (nunamicina, nunapeptina, brasamicina y braspeptina) que son esenciales en la función antifúngica, las fenazinas, sesilinas y orfamidas, y varias enzimas (quitinasas, glucanasas y proteasas) que son supresores de algunas enfermedades fúngicas, las más comunes y estudiadas son 2,4‐diacetilfloroglucinol, fenazina‐1‐ácido carboxílico, fenazina-1-carboxamida, pioluteorina y pirrolnitrina (Dimkić et al., 2022).
Bacterias como P. fluorescens puede producir pioluteorina, pirrolnitrina y HCN en cantidades variables, y una alta actividad de enzimas líticas, que podrían afectar P. capsici inhibiendo el crecimiento micelial en hasta el 72%, la producción completa de esporangios en la fase más explosiva, y la germinación indirecta de esporangios (liberación de zoosporas) entre 89% y 98% (Paul & Sarma, 2006). Así mismo, el antibiótico G26A (Figura 4; análogo de las fenazinas: ácido fenazina-1-carboxílico) obtenido a partir de P. aeruginosa afecta negativamente los fitopatógenos C. orbiculare, Pythium ultimum y P capsici en plantas de pimiento (Lee et al., 2003).
Streptomyces spp.
Streptomyces spp. produce compuestos bioactivos clínicamente importantes con propiedades anticancerígenas, antivirales y antibacterianas, pudiendo tener papeles importantes en varios campos como la medicina, pero también en la agricultura (Abbasi et al., 2020; Khushboo et al., 2021). En el campo de la sanidad vegetal, estas actinobacterias han demostrado su potencial in vitro como antagonistas de diferentes especies de Phytophthora, posiblemente debido a la producción de importantes productos naturales (Trinidad-Cruz et al., 2021). Streptomyces incluso parece modular ciertos mecanismos de defensa en plantas contra P. capsici (Abbasi et al., 2020).
En condiciones in vitro, se ha demostrado que Streptomyces spp. tiene un efecto directo contra P. capsici. Por ejemplo, S. rhizophila, Streptomyces ABV38 y ABV45 inhiben el crecimiento micelial de P. capsici entre 30 y 50% (Ramírez et al., 2015; (Trinidad-Cruz et al., 2021). S. plicatus y sus filtrados pueden incluso suprimir hasta un 75% el crecimiento micelial de P. cinnamomi, P. palmivora y P. parasitica y P. capsici (Chen et al., 2016). Así mismo, S. rochei inhibe el crecimiento radial de P. capsici en 40 y 81% a las 48 y 96 h, respectivamente, e invade completamente la colonia, desintegrándola y esporulando sobre ella a los 7 días (Ezziyyani et al., 2004). El efecto directo de la actinobacteria sobre el oomiceto, parece deberse al hiperparasitismo ejercido por este (Chen et al., 2016). De hecho, esto ha quedado demostrado mediante estudios de microscopia electrónica de barrido, que en la zona de inhibición existe un enrollamiento masivo de hifas de P. capsici por S. rochei, provocando incluso lisis y desintegración de hifas del fitopatógeno (Ezziyyani et al., 2004).
Aunque el control ejercido por bioncontroladores en condiciones in vitro es casi un hecho, en condiciones in vivo su eficiencia no es la esperada. Sin embargo, existen evidencias que el uso Streptomyces puede ayudar a reducir enfermedades causadas por P. capsici en diferentes cultivos (Figura 3). Al respecto, S. rhizophila puede reducir la severidad de pudrición del cuello y de marchitez en pimiento, ambas causadas P. capsici, y aumentar incluso el 14% del peso fresco de hojas en ese cultivo (Ramírez et al., 2015). Otra especie como S. rochei, aplicada también en plantas de pimiento puede reducir el marchitamiento de P. capsici hasta en 65%, e incluso inducir un color verde más intenso, pero no generar cambios en el peso seco ni en la longitud de las plántulas frente al control (Ezziyyani et al., 2004). En macetas, se ha observado también el efecto protector de S. griseus contra P. capsici en pimiento, reduciendo en 47% la mortalidad causada por pudrición de raíz, y aumentando en 18 y 56 % los brotes frescos y el crecimiento de las plantas, respectivamente, en comparación al control (Nguyen et al., 2012). Filtrados de cultivo de Streptomyces también pueden reducir o suprimir la pudrición de cuello y marchitamiento causada por P. capsici (Chen et al., 2016; Trinidad-Cruz et al., 2021).
Existen evidencias de antagonismo por parte de Streptomyces contra P. capsici, mediante la producción de metabolitos antifúngicos que inhiben su crecimiento micelial en condiciones in vitro (Nguyen et al., 2015), como ácido 1H-pirrol-2-carboxílico (PCA) (Nguyen et al., 2015) y borrelidina (Chen et al., 2016). Especies como S. griseus puede producir también las enzimas líticas como quitinasa, β-1,3-glucanasa, lipasa y proteasa, observándose incluso una alta actividad de las dos primeras en la rizósfera y raíces de pimiento (Nguyen et al., 2012).
Sobre la inducción de resistencia o defensa inducida por Streptomyces en pimiento es casi nula, encontrándose únicamente pocos estudios como el de Abbasi et al. (2020) en pimienta negra. Ellos evaluaron el efecto de S. rochei y S. vinaceusdrappus sobre la inhibición de P. capsici, control de la marchitez, promoción del crecimiento reproductivo, defensa inducida en plantas mediante la producción de especies reactivas de oxígeno (ROS; Figura 4), y cambios transcripcionales de genes seleccionados en tejidos de hojas y frutos. La combinación de las dos especies bacterianas redujo el oomiceto y la enfermedad en condiciones in vitro e in vivo, e indujo una acumulación diferenciada de peróxido de hidrógeno (H2O2) y una expresión del gen GST (Figura 4; transcritos de glutationa S-transferasa), en comparación con los tratamientos individuales tras la inoculación del oomiceto. Además, se observó el incre mento de la longitud de brotes, la floración y el peso de frutos en las plantas sanas en comparación con el control. Probablemente, estos cambios dependieron de las rela ciones coordinadas entre PR1, los genes ACCO [Figura 4; 1-aminociclopropano-1-ácido carboxílico (ACC) oxidasa] y los factores de transcripción WRKY40, inducidos después de la inoculación con P. capsici. Los autores concluyen que la inducción de defensa en las plantas se debió a la regu lación ascendente de SUS (transcritos de sacarosa sintasa) y a la regulación diferencial de genes dependientes de ET.
Trichoderma spp.
El género Trichoderma con más 250 especies (Bissett et al., 2015), es un ascomiceto que se reproduce normalmente mediante la producción de conidios y clamidosporas, y en hábitats silvestres mediante ascosporas (Mukherjee et al., 2013). Este hongo filamentoso ampliamente estudiado y utilizado como agente de biocontrol en la agricultura contra hongos y pseudohongos fitopatógenos, debido principalmente a su capacidad para parasitarlos (micoparasitismo), y que parece también controlar insectos plaga, tanto directa como indirectamente (Poveda, 2021). Trichoderma es un componente dominante de varios micobiomas del ecosistema del suelo, que se caracterizan por la capacidad de colonizar las raíces de las plantas (Morán-Díaz et al., 2021; Tyśkiewicz et al., 2022). Algunas especies como T. afroharzianum, T. asperellum, T. atroviride, T. brevicompactum, T. citrinoviride, T. dorothopsis, T. harzianum, T. koningiopsis y T. virens han demostrado ser antagonistas contra P. capsici (Bae et al., 2011; Jiang et al., 2016; Tomah et al., 2020). Hasta el momento se ha secuenciado el genoma completo de seis especies de Trichoderma (Mukherjee et al., 2013). La eficiencia de control ejercida por algunas de estas especies podría incluso ser comparada con el uso de moléculas sintéticas (Segarra et al., 2013).
Trichoderma parece afectar directamente a P. capsici. Tal vez, uno de los trabajos más relevantes respecto a este proceso, ha sido el realizado por Jiang et al. (2016) con T. asperellum y el oomiceto. Ellos detallan que hifas de T. asperellum rodean y penetran hifas del fitopatógeno, provocando el colapso de P. capsici, y a los 7 días después de la inoculación su degradación completa. Parece que el hongo ingresa a las oosporas de P. capsici, conduciéndolas a su desintegración y a la de oogonios y oosporas, aumentando temporalmente este efecto. Ese micoparasitismo ejercido por Trichoderma, parece ser un rasgo ancestral de este género fúngico (Mukherjee et al., 2013).
Trichoderma reduce varias enfermedades causadas por P. caspici en diferentes vegetales. T. harzianum puede reducir progresivamente a P. capsici en el sustrato infestado a lo largo del tiempo, y por ende disminuir también hasta en 76%, la pudrición de raíz en pimienta negra, en comparación con las plantas control (Ahmed et al., 1999). Otras como T. virens puede retrasar la aparición del tizón y reducir significativamente la intensidad de la enfermedad en 63% y 64% en pimiento, respectivamente (Tomah et al., 2020). Incluso la reducción de pudrición de raíz causada por P. capsici, ejercida por T. asperellum, se puede equiparar a la de la molécula etridiazol aplicada al mismo tiempo que el oomiceto, demostrando que no se requiere la colonización previa del sustrato por el biocontrolador para el manejo exitoso de P. capsici (Segarra et al., 2013).
Varios factores podrían afectar la capacidad de Trichoderma spp. para controlar enfermedades como las causadas por P. capsici. Por ejemplo, Ahmed et al., (1999) mencionan que la capacidad de inhibición presentada por especies como T. harzianum sobre el oomiceto, depende del medio donde estos se encuentren. Así mismo, Hoitink et al. (2006) mencionan que el control proporcionado por Trichoderma es más efectivo en plantas cultivadas en medios modificados, en comparación con los que contienen menor capacidad de carga microbiana. De igual manera, especies como T. hamatum suprime sig nificativamente el tizón del tallo e incrementa el vigor de plantas del genotipo susceptible de azalea (Rhododendron spp.) cv. Roseum elegante, pero no suprime la enfermedad en los cultivares altamente susceptibles Aglo y PJM Elite a pesar de incrementarse el vigor de estos.
Gracias a la secuenciación de varias especies de Trichoderma, se ha descubierto un amplio re pertorio de metabolitos secundarios y numerosas proteí nas pequeñas secretadas especialmente ricas en cisteína producidos por estos microorganismos, algunos de los cuales tienen no solo importancia agrícola, sino también clínica (Mukherjee et al., 2013). Estos metabolitos están comprendidos por compuestos que tienen bajo peso mo lecular, difusibles en medio de cultivo o en su caso voláti les, siendo sintetizados por medio de varias vías metabólicas (Brakhage, 2013).
Trichoderma promueve el crecimiento y desarrollo de las plantas mediante la producción de fitohormonas como auxinas, giberelinas, e incluso también ácidos orgánicos (glucómico, fumárico y cítrico), los cuales son capaces de disminuir el pH del suelo y propiciar la solubilización de fosfatos, magnesio, hierro y magnesio para el metabolismo de la planta (Sharma et al., 2017; Hernández-Melchor et al., 2019; Tyśkiewicz et al., 2022). Así mismo, la mayoría de las especies de Trichoderma producen la enzima 1-aminociclopropano-1-carboxilato (ACC desaminasa; Figura 4), el cual es un mecanismo utilizado por algunos microorganismos para promover el crecimiento de plantas influenciadas por el estrés ambiental, trayendo ventajas importantes como la disminución de concentraciones de ET en la planta y el incremento de la disponibilidad de amonio en la rizósfera (Esquivel-Cote et al., 2013). Algunas cepas de T. atroviride pueden también mostrar una actividad antagónica directa contra P. nicotianae, así como un efecto promotor del crecimiento en plantas de tomate (La Spada et al., 2020).
Otra de las potencialidades de Trichoderma es la producción de metabolitos secundarios (Figura 4), los cuales pueden agruparse en peptaiboles (pequeños péptidos de origen no ribosomal), pequeños NRP (gliotoxina y sideróforos), policétidos, (Mukherjee et al., 2013), terpenoides volátiles y no volátiles (viridina y el viridiol producidos por T. virens), tricotecenos (tricodermina y harzianum A), 6-pentil-2H-piran-2-ona (6-PP) que derivan del ácido linoleico, entro otros (Serrano-Carreon et al., 1993; Mukherjee et al., 2013; Tomah et al., 2020). Por ejemplo, la gliotoxina (Figura 4; segundo antibiótico descubierto junto a la penicilina) producida por T. virens inhibe varios hongos y bacterias fitopatogénicas al tener un enlace disulfuro o polisulfuro (Jayalakshm et al., 2021), mejorando el potencial biocontrolador (Tomah et al., 2020). La estabilidad de este NRP está influenciada principalmente por la humedad, la comunidad microbiana y las condiciones de pH del suelo (Jayalakshm et al., 2021). La gliotoxina producida por T. virens provocaría el colapso y degradación de P. capsici (Tomah et al., 2020).
Trichoderma produce una gran variedad de en zimas, como quitinasas y glucanasas (Figura 4) que pue den romper la pared celular de fitopatógenos, e inducir mecanismos defensa en plantas (Küçük & Kivanç, 2003). Enzimas como proteasas, producidas por especies como T. harzianum pueden inactivar y descom poner enzimas hidrolíticas producidas por P. capsici (SidAhmedet al., 1999). Trichoderma puede in ducir respuestas de defensa en raíces cuando fitopatóge nos penetran su región rizodérmica, aumentando la actividad de las enzimas peroxidasa y quitinasa, así como la deposición de calosa en sus paredes celulares (Figura 4) (Yedidia et al., 2000; La Spada et al., 2020). T. viride aplicado en diferentes intervalos de tiempo, puede brindar protección a plantas de pimienta negra contra la infección por P. capsici, mediante el aumento de la actividad enzimática de quitinasa, peroxidasa, fenilalanina amonio liasa, polifenol oxidasa, β-1,3-glucanasa y del contenido de fenoles (Shobha et al., 2019).
Yedidia et al. (2000) cuantificaron las PR y la actividad enzimática de T. harzianum después de la penetración y colonización de raíces de pepino, el biocontrolador indujo una mayor actividad de qui tinasa, β-1,3-glucanasa, celulasa y peroxidasa, en comparación con los tejidos no tratados, hasta 72 h después de la inocula ción. La formación de productos fluorescentes principalmente en espacios intercelulares de raíces proporcionó evidencia de la participación del sistema de defensa de la planta. La reconocida naturaleza micoparásita de Trichoderma, sugiere que este organismo reduce las enfermedades en raíces a través de la activación de la respuesta de defensa de la planta.
Fitopatógenos como P. capsici produce diversos péptidos y moléculas pequeñas denominados de efectores, que este usa para manipular o inhibir las respuestas de defensa de las plantas de Capsicum (Gaibor-Vaca et al., 2022). Sin embargo, la colonización de tejidos vegetales en sistemas fúngicos y bacterianos patogénicos o no, se rige por moléculas efectoras como proteínas, metabolitos secundarios y pequeños ARN secretados por microorganismos, que suprimen las respuestas de defensa vegetal y modulan su fisiología para promover la virulencia o la compatibilidad (Ramírez-Valdespino et al., 2019). Actualmente, se conoce que Trichoderma posee patrones moleculares estructurales y secretados asociados a microbios (MAMP) y patrones moleculares asociados a daños (DAMP; Figura 4), que resultan de la actividad enzimática de su pared celular (CWDE) sobre fitopatógenos, de modo que, inducen diferentes mecanismos de defensa o respuestas de crecimiento (Hermosa et al., 2013).
Más allá de la producción de enzimas y metabolitos que degradan la pared celular de fitopatógenos, Trichoderma puede proteger las plantas mediante la inducción de defensa más rápida y fuerte, un mecanismo conocido como cebado o “priming”, que implica una mayor acumulación de proteínas celulares latentes que funcionan en la amplificación de la señal intracelular (Morán-Diez et al., 2021). Este género fúngico puede inducir la expresión de genes relacionados con la defensa vegetal y un gen afín con el micoparasitismo, así como generar una mar cada regulación hacia arriba de efectores de P. nicotianae (Figura 4) como PnNPP1.1 y PnNPP1.3, y al mismo tiempo, una ligera regulación a la baja de PpCRN4 y PpCBEL4 (La Spada et al., 2020). Trichoderma puede inducir una mayor acumulación de proteínas celulares que am plifican la señal intracelular, como la proteína quitinasa, estimuladas por el aumento de niveles de calcio citosólico y los cambios redox celulares en plantas, pudiendo estar involucrado en la regulación epigenética de plantas a través de modificaciones y reemplazos de histonas, metilación del ADN y metilación del ADN dirigido por ARN (Morán-Diez et al., 2021).
En interacciones tripartitas se ha observado que algunas cepas de Trichoderma pueden inducir una clara respuesta de defensa en plantas inoculadas o infectadas con P. caspici. Bae et al. (2011) encontraron que plantas de ají cuyas raíces fueron pre-colonizadas por algunos aislados ecuatorianos y peruanos de Trichoderma, aparte de observar una reducción significativa del progreso de pudrición de cuello causada por P. capsici, verificaron una inducción de etiquetas de secuencia relacionadas con la defensa (EST), incluidos múltiples miembros de la familia de la proteína lípido transferasa (LTP), incluso la expresión de CaLTP-N que codifica una proteína similar a la LTP. Algo similar fue observado por Umadevi & Anandaraj (2019) en pimienta negra usando proteómica cuantitativa, las plantas de esta especie tratadas con una cepa de T. harzianum e infectadas con P. capsici, presentaron una inducción sistémica mediada por Trichoderma, mediante la expresión de 18 proteínas relacionadas con ROS, así como 22 proteínas ligadas con la defensa asociadas a la ruta de isoflavonoides y síntesis de ET y lignina.
Otros de los compuestos que pueden ser inducidos en plantas por microrganismos fitopatógenos o benéficos son las fitohormonas, auxinas, giberelinas, entre otros. Estos compuestos producidos en células vegetales se acumulan en cantidades variables tras el reconocimiento de microbios, dando lugar a la activación de diversos mecanismos de defensa (Gaibor-Vaca et al., 2022). De cualquier manera, Trichoderma también puede inducir una resistencia duradera en plantas contra algún estrés biótico o abiótico, al equilibrar las diferentes vías dependientes de SA, JA, ET, y ácido abscísico (ABA), pero también la auxina IAA y las giberelinas o ácido giberélico (GA), y que modulan niveles de proteínas reguladoras de la defensa y del crecimiento (Figura 4; Hermosa et al., 2013; La Spada et al., 2020). Sin embargo, Hermosa et al. (2013) precisan que el nivel de algunas fitohormonas en las plantas puede ser influenciada por la producción de compuestos producidos por Trichoderma. Por ejemplo, la ACC desaminasa de ese biocontrolador reduce la señalización de ET conduciendo a una reducción del ABA y un aumento del nivel de GA, y represión de proteínas ligadas a jasmonatos promoviendo el crecimiento vegetal. La producción de IAA del hongo estimula la biosíntesis de ET a través de la ACC sintasa, desencadenando un aumento en la biosíntesis de ABA, y una reducción del nivel de GA, contribuyendo a la rápida activación de la señalización y la defensa vegetal vía JA (Figura 4). El IAA puede incluso ser antagonista de SA, comprometiendo la supresión del crecimiento vegetal, pero como se dijo antes, puede estar ayudando en la inducción de respuestas de defensa vegetal (Hermosa et al., 2013).
5. ¿La inducción de mecanismos de defensa en plantas de Capsicum ejercida por microrganismos es mito o realidad?
Los fitopatógenos durante su evolución desarrollaron mecanismos para la obtención de nutrientes de su huésped, mientras que las plantas presentan barreras físicas, químicas y moleculares para dificultar el progreso de esos microrganismos, desarrollando la capacidad de reconocer DAMP, así como MAMP o Patrones Moleculares Asociados a Patógenos (PAMP), a través de Receptores de Reconocimiento de Patrones (PRRs) localizados en la membrana celular (Figura 4; Gaibor-Vaca et al., 2022). En interacciones incompatibles, los genotipos resistentes de Capsicum tienen la capacidad de retrasar o evitar el crecimiento de P. capsici en sus tejidos. Como resultado, las plantas presentan síntomas imperceptibles, o casi nulos tanto interna como externamente en tejidos como raíces y tallos, debido a que el oomiceto llega con considerable retraso a tejidos superiores como hipocótilos, resultando en menor colonización e intensidad de síntomas en esas plantas resistentes, comparado a las susceptibles (Saltos et al., 2021). Hay que considerar que la mayoría de genotipos de Capsicum establecidos en zonas productoras del mundo, son susceptibles o tolerantes a P. capsici. Así, podrían ser usados diferentes biocontroladores como Bacillus, Pseudomonas, Streptomyces y Trichoderma, que aparte de mostrar una eficiente actividad antimicrobiana contra P. capsici, estos activen diferentes mecanismos de defensa en plantas de Capsicum contra el oomiceto.
Hasta la presente fecha, se han identificado pocos estudios donde se ha evaluado el efecto inducido por especies de los cuatro biocontroladores abordados en la presente revisión, sobre mecanismos bioquímicos y moleculares relacionados a la promoción del crecimiento vegetal, y a la defensa contra P. capsici en plantas de Capsicum. De hecho, varios aislados de especies de Bacillus, Pseudomonas y Streptomyces han sido consideradas como PGPR (Hyder et al., 2020; Dimkić et al., 2022; Abbasi et al., 2020; La Spada et al., 2020), induciendo un aumento de resistencia sistémica adquirida, supresión de enfermedades, producción de fitohormonas y absorción de nutrientes, y estimulando el crecimiento en plantas (Figura 3; Hashem et al., 2019; Amaresan et al., 2018).
De manera general, la expresión de genes que codifican PR y otras proteínas relacionadas con la defensa en plantas hospedantes a través de la activación de las vías de señalización del JA, SA o ET, pueden ser inducidos por lipopéptidos, policétidos y volátiles de Bacillus spp. en algunas especies vegetales (Figura 4; Dimkić et al., 2022). De hecho, B. subtilis puede brindar protección a plantas de pimienta negra contra la infección por P. capsici, mediante el aumento de la actividad enzimática de quitinasa, peroxidasa, fenilalanina amonio liasa, polifenol oxidasa, β-1,3-glucanasa y del contenido de fenoles (Shobha et al., 2019). En el caso de Pseudomonas, a pesar de conocer un sinnúmero de moléculas involucradas en diferentes interacciones planta-patógeno-antagonista (Dimkić et al., 2022), se desconoce los mecanismos bioquímicos y moleculares inducidos por Pseudomonas en plantas de Capsicum infectadas con P. capsici. Esto es retórico con Streptomyces, encontrándose únicamente el estudio realizado en pimienta negra por Abbasi et al. (2020). Ellos observaron que S. rochei y S. vinaceusdrappus genera una defensa inducida en plantas mediante la producción de ROS (Figura 4) y cambios transcripcionales de genes seleccionados en tejidos de hojas y frutos, concluyendo que la inducción de defensa en pimienta negra se debe a la regulación ascendente de SUS y a la regulación diferencial de genes dependientes de ET.
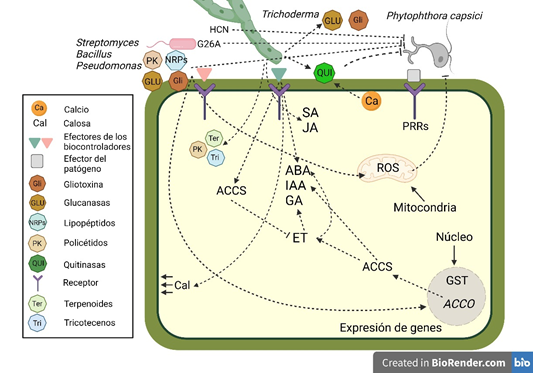
Figura 4 Interacción bioquímica y molecular entre el oomiceto Phytophthora capsici, biocontroladores (Bacillus, Pseudomonas, Streptomyces y Trichoderma) y células epidérmicas (hojas) y rizodérmicas (raíces) de Capsicum. ABA: ácido abscísico. ACCS: enzima 1-aminociclopropano-1-ácido carboxílico (ACC) sintasa. ACCO: genes 1-aminociclopropano-1-ácido carboxílico (ACC) oxidasa. Cal: calosa. ET: etileno. GA: ácido giberélico. G26A: análogo de las fenazinas: ácido fenazina-1-carboxílico. GST: transcritos de glutationa S-transferasa. HCN: cianuro de hidrógeno. IAA: ácido indol-3-acético. JA: ácido jasmónico. PRRs: receptores de reconocimiento de patrones. ROS: especies reactivas de oxígeno. SA: ácido salicílico.
Al igual que con las bacterias, los estudios con Trichoderma en Capsicum a nivel bioquímico y molecular también son casi nulos. Sin embargo, Trichoderma promueve la activación de procesos dependientes como la producción de AS, ET y JA en plantas de tomate (La Spada et al, 2020). En plantas de pimiento, varias especies de Trichoderma pueden inducir etiquetas de secuencia relacionadas con la defensa (EST), incluidos múltiples miembros de la familia de la LTP en pimiento después de la inoculación con P. caspici, afectando la colonización de los tejidos por el oomiceto y el desarrollo de la pudrición de raíz y cuello. A pesar de que este efecto depende del aislado de Trichoderma usado, estos microorganismos pueden retrasar el desarrollo de enfermedades por P. capsici y también inducir fuertes y divergentes reacciones de defensa (Bae et al., 2011). Otro dato interesante, es que Trichoderma no solo puede estar involucrado en la regulación genética de plantas, sino también en la epigenética a través de modificaciones y reemplazos de histonas, metilación del ADN y metilación del ADN dirigido por ARN (Morán-Diez et al., 2021).
Independiente del cultivo, se necesitan estudios detallados sobre enfoques moleculares e independientes, que ayuden a descifrar los mecanismos subyacentes de supresión de enfermedades en el suelo para aprovechar los mayores beneficios de la "microbiota del suelo" (Jayaraman et al., 2021). Incluso una mejor comprensión del microbioma con las diferentes especies vegetales aumentará nuestra capacidad para manipular de manera eficiente los sistemas de plantas y microbios, y así obtener resultados estables y predecibles en campos abiertos (Abbasi et al., 2021). En la actualidad, nuevas herramientas o estrategias como la secuenciación de próxima generación que caracterizan en profundidad las comunidades bacterianas y fúngicas del suelo e incluso de tejidos de Capsicum afectados o no por P. capsici, pueden ayudar al estudio de microbiomas.
Destaque aparte merece el hecho de existir muy pocos trabajos sobre la inducción de defensa en plantas de Capsicum contra P. capsici, ejercido por Bacillus, Pseudomonas, Streptomyces o Trichoderma. Por ejemplo, el estudio de moléculas efectoras producidas por microorganismos se ha enfocado en interacciones dañinas (fitopatógenos). Sin embargo, recientemente se ha comenzado a estudiar los efectores en interacciones simbióticas, encontrando que la mayoría de los efectores simbióticos son miembros de las mismas familias presentes en fitopatógenos (Ramírez-Valdespino et al., 2019). Podría entenderse que no todos los laboratorios están preparados o alineados en el estudio de la interacción tripartita biocontrolador-Capsicum-P. capsici, pero se debería hacer un esfuerzo para elucidar los mecanismos vegetales de defensa relacionados. Incluso la información generada a partir de estas investigaciones posiblemente genere un aumento del uso de estos microorganismos en los cultivos de ajíes y pimiento. Finalmente, descifrar dichos mecanismos en plantas contra fitopatógenos en un escenario donde la actividad antagónica y los efectos promotores del crecimiento vegetal por biocontroladores, es una nueva frontera dentro del área de la fitopatología (La Spada et al., 2020).
En función de la información obtenida y presentada en esta revisión, se ha tratado de ejemplificar y elucidar la interacción bioquímica y molecular entre el oomiceto P. capsici, biocontroladores y células epidérmicas (hojas) y rizodérmicas (raíces) de Capsicum (Figura 4). En primera instancia, efectores pueden o no ser reconocidos por receptores de reconocimiento de patrones (PRRs) de la planta; cuando no, el oomiceto ingresa dentro de la célula y puede lograr una interacción parasitaria estable con la planta. Bacterias como Bacillus, pueden producir sustancias antimicrobianas como PK y NRPs, además de HCN y IAA. Por su parte, Pseudomonas produce el antibiótico G26A, y Streptomyces induce los genes ACCO que sintetiza la enzima ACC oxidasa. En el caso de Trichoderma, estos también producen metabolitos secundarios como PK, terpenoides, tricotecenos, e incluso induce el aumento de quitinasa estimulado a la vez por los niveles de Ca+2, lo cual inhibe y degrada el desarrollo de P. capsici. Trichoderma también produce el antibiótico gliotoxina, y glicoproteinas y glucanasa, que pueden romper la pared celular del patógeno o inducir mecanismos de defensa como el reforzamiento de la pared celular mediante la deposición de calosa. Finalmente, Trichoderma induce resistencia duradera en la planta equilibrando los niveles de SA, JA, ABA, IAA, GA y ET, pero además produce la enzima ACC desaminasa que es sintetizada dentro de la célula con lo cual disminuyen los niveles de ET, sin embargo, el hongo produce también IAA aumentando así los niveles de ET.
6. Perspectivas actuales y futuras
A pesar de todos los avances realizados hasta la presente fecha, falta aún mucho por elucidar. Tal vez, en las próximas investigaciones relacionadas al uso de biocontroladores de P. capsici en plantas de Capsicum o incluso en otros patosistemas, se podría dar más énfasis en (a) el uso de métodos de secuenciación de próxima generación para caracterizar más a profundidad la microbiota (principalmente bacterias y hongos) presente en suelos y tejidos; (b) las bioformulaciones basadas en componentes volátiles donde se use nanotecnología; (c) empleo de biooomiceticidas basados preferencialmente en aislados locales, lo que evitaría la introducción de otros microorganismos en el nicho ecológico; (d) el empleo de aislados microbianos caracterizados bioquímica (compuestos bioactivos) y molecularmente, confirmando que no son una amenaza para los seres vivos; y (e) el acompañamiento temporal constante de la microbiota en suelos y tejidos vegetales.
7. Conclusiones
Phytophthora capsici puede fácilmente ser considerado uno de los principales patógenos que afecta varias Cucurbitáceas, Fabáceas, Rosáceas y Solanáceas, que incluyen al género Capsicum. Este oomiceto causa diversos síntomas como pudrición de raíz, cuello, tallo y fruto, y tizón foliar en plantas de ají y pimiento. Una de las medidas para el manejo de alguna de esas enfermedades en plantas de Capsicum, es el uso de microorganismos como Bacillus, Pseudomonas, Streptomyces y Trichoderma. Los biocontroladores aparte de actuar como bioestimulantes mejorando algunos componentes agronómicos y productivos en plantas, podrían inhibir y reducir el crecimiento de P. capsici, afectando negativamente el desarrollo de esporangios, germinación y motilidad de zoosporas, y crecimiento del tubo germinativo, debido posiblemente a un sinnúmero de metabolitos volátiles y no volátiles producidos por los microorganismos. Esto haría que los síntomas se reduzcan en las plantas. Sin embargo, hay muchos indicios de la activación de respuestas de defensa en plantas contra P. capsici inducidas por los microorganismos. Estos estimulan eficientemente en plantas infectadas o no con P. capsici, la actividad de varias enzimas relacionadas con las vías de isoflavonoides y especies reactivas de oxígeno, así como la expresión de diferentes genes que codifican proteínas relacionadas con la patogénesis, y otras que pueden activar las vías de señalización del ácido salicílico, ácido jasmónico o etileno. Muchos autores se atreven incluso a concluir que la eficiencia de control mostrada por algunos microorganismos puede compararse con la de algunos oomiceticidas comerciales. De cualquier manera, la eficiencia o activación de algunos u otros mecanismos bioquímicos o moleculares en plantas estarían relacionados a la especie y cepa del biocontrolador.















