Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.4 Lima oct./dic. 2018
http://dx.doi.org/10.31403/rpgo.v64i2128
SIMPOSIO CIRUGÍA FETAL EN AMÉRICA LATINA
Cirugía fetal láser en síndrome de transfusión feto feto y restricción selectiva del crecimiento intrauterino
Laser fetal surgery in feto-fetal transfusion syndrome and selective intrauterine fetal growth restriction
Saulo Molina-Giraldo1,a, Cristian Hincapié-Porras1,b
1. Unidad de Terapia, Cirugía Fetal y Fetoscopia, División de Medicina Materno fetal, Departamento de Obstetricia y Ginecología, Hospital de San José y Departamento de Ginecología y Obstetricia, Fundación Universitaria de Ciencias de la Salud – FUCS, Bogotá – Colombia.
a. M.D., MSc, PhD(e)
b. MD
ABSTRACT
Introduction: The monochorionic biamniotic twin pregnancy (MCBA) corresponds to approximately 15% of all twin pregnancies and an estimate of 10-15% develop complications proper of these types of pregnancies, such as selective intrauterine fetal growth restriction (IUGRs) and feto-fetal transfusion syndrome (FFTS). Laser fetal surgery allows treatment of these hemodynamic alterations of MCBA by fulguration of placental anastomoses, and it is currently considered the first-choice therapy for FFTS and some IUGR cases. Objectives: To highlight the general aspects of laser fetal surgery and to describe current evidence of its efficacy and safety in FFTS and IUGRs. Methods: Review of articles published during the last five years in indexed journals from the following databases: PUBMED, MEDLINE, EMBASE and Cochrane Library. Review papers, original papers, and systemic reviews were included. Classic relevant papers on fetal surgery history were also included. Results: By means of this nonsystematic review of the literature, 43 articles were considered for the present paper. Conclusion: This review evidences that laser fetal surgery improves the prognosis of FFTS fetuses. The use of this therapy in IUGRs cases has not improved survival.
Key words: Twin pregnancy, Monochorionic biamniotic, Intrauterine fetal growth restriction, Feto-fetal transfusion syndrome selective.
RESUMEN
Introducción. El embarazo gemelar monocorial biamniótico (MCBA) corresponde aproximadamente al 15% de los embarazos gemelares y, de estos, se estima que 10 a 15% desarrollan complicaciones propias de este tipo de embarazos, como la restricción selectiva del crecimiento intrauterino (RCIUS) y el síndrome de transfusión feto (STFF). La cirugía fetal láser permite tratar la causa de estas alteraciones hemodinámicas propias de los embarazos MCBA a través de la coagulación de las anastomosis placentarias, y es considerada actualmente la terapia de elección en el STFF y aplicable en algunos casos de RCIUS. Objetivos. Resaltar los aspectos generales de la cirugía fetal láser y describir la evidencia actual de la eficacia y seguridad de su uso en el STFF y la RCIUS. Metodología. Se realizó una búsqueda de la literatura de artículos publicados en revistas indexadas en las siguientes bases de datos: PUBMED, MEDLINE, EMBASE, Cochrane Library. Se incluyeron revisiones de tema, investigaciones originales y revisiones sistemáticas de la literatura, publicadas en los últimos 5 años. Además, se incluyen artículos clásicos relevantes en la historia de la cirugía fetal. Resultados. Producto de la revisión no sistemática de la literatura, se incluyeron 43 para la construcción de la presente revisión. Conclusiones. La presente revisión evidencia que la cirugía láser fetal mejora el pronóstico de los fetos con STFF. El uso de dicha terapia para los casos de restricción de crecimiento intrauterino selectivo no ha mejorado la sobrevida.
Palabras clave. Embarazo gemelar, monocorial biamniótico, Restricción del crecimiento fetal intrauterino, Síndrome de transfusión feto-fetal selectiva.
Introducción
Los embarazos gemelares aportan aproximadamente al 3% de todos los nacimientos; son responsables del 6,3% de las muertes fetales y el 12% de las muertes neonatales(1). El embarazo gemelar monocorial biamniótico (MCBA) corresponde a aproximadamente el 15% de los embarazo gemelares(2) y, de estos, se estima que entre 10 y 15% desarrollan complicaciones propias de este tipo de embarazos, como la restricción selectiva del crecimiento intrauterino (RCIUS)(3,4), el síndrome de transfusión feto feto (STFF)(5,6), la secuencia anemia policitemia y el síndrome de perfusión arterial reversa (conocidos como TAPS y secuencia TRAP, respectivamente, por sus siglas en inglés) (7). Además, presentan mayor riesgo de muerte fetal intrauterina comparado con los embarazos gemelares bicoriales biamnióticos(7).
El STFF y la RCIUS comparten en común mecanismos fisiopatológicos derivados de la interdependencia de los fetos a través de conexiones vasculares placentarias(3,8). En la placenta de los embarazos (MCBA) existen anastomosis vasculares superficiales y profundas; estas últimas corresponden a conexiones entre arterias y venas(1). Las anastomosis arterio-venosas (AV) son unidireccionales; las anastomosis arterio-arteriales (A-A) y veno-venosas (V-V) son superficiales y tienen un flujo bidireccional; ayudan a equilibrar el flujo entre ambos territorios placentarios y su presencia es fundamental para prevenir la aparición del STFF. Este intercambio bidireccional permite contrarrestar la diferencia de flujo a través de las anastomosis placentarias profundas(1). La mortalidad perinatal en el STFF sin tratamiento es 90 a 100%(5).
Aunque la etiología de la RCIUS no está completamente dilucidada, se especula que esta condición se produce como consecuencia de una distribución desigual del territorio placentario entre ambos fetos, inserción anormal del cordón y desequilibrio en el flujo sanguíneo por anastomosis entre las dos circulaciones(9). El riesgo de mortalidad global en la RCIUS es de 4,1%, 16,1% y 11,5% para tipo I, tipo II y tipo III, respectivamente(10). La muerte de uno de los fetos por cualquier etiología en el segundo y tercer trimestre en los embarazos MCBA, produce un riesgo significativo de morbilidad neurológica, con hallazgos anormales en las neuroimágenes en 34% de los fetos sobrevivientes(11).
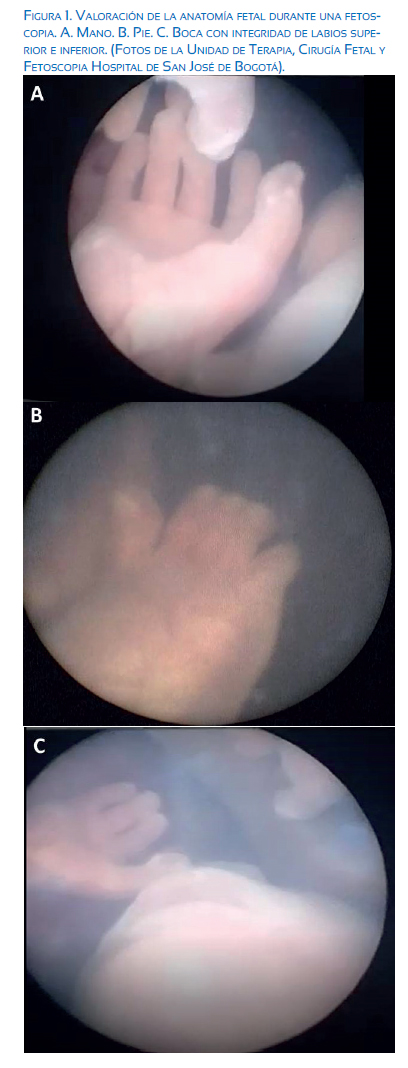
La visualización mediante fetoscopia y la cirugía fetal laser permiten tratar la causa de estas alteraciones hemodinámicas propias de los embarazos MCBA a través de la coagulación de las anastomosis placentarias, y es considerada actualmente la terapia de elección en el STFF y aplicable en algunos casos de RCIUS(2) (figura 1). El objetivo de la presente publicación es resaltar los aspectos generales de la cirugía fetal láser y describir la evidencia actual de la eficacia y seguridad de su uso en el STFF y la RCIUS.
Métodos
Se realizó una búsqueda de la literatura de artículos publicados en revistas indexadas en las siguientes bases de datos PUBMED, MEDLINE, EMBASE, Cochrane Library, incluyendo los siguientes términos Mesh: "Fetoscopic laser surgery", "Monochorionic twins", "Twin-twin transfusión syndrome", "Selective intrauterine growth restriction". Se incluyeron artículos de revisión, investigaciones originales y revisiones sistemáticas de la literatura, publicadas en los últimos 5 años en los idiomas inglés y español. Además, se incluyen artículos clásicos relevantes en la historia de la cirugía fetal.
Resultados
Producto de la revisión no sistemática de la literatura, incluyendo los términos MESH anteriormente descritos y aplicando como filtro de búsqueda los últimos 5 años, se obtuvieron 378 títulos entre revisiones de tema, artículos originales y revisiones sistemáticas de la literatura. Inicialmente se descartaron 250 artículos por la relevancia de su contenido, por la limitación al acceso del texto completo y por idiomas diferentes a los indicados. De los 128 restantes, se seleccionaron 43 después de una revisión manual de su contenido para la construcción de la presente revisión.
Cirugía fetal láser
El objetivo de la medicina materno fetal es el estudio del embarazo de alto riesgo y el feto, no solo con fines diagnósticos y pronósticos, sino también interviniendo para modificar el curso de las condiciones patológicas potencialmente mortales o que implican alta morbilidad(12). La realización de ecografía obstétrica al universo de las gestantes, ha permitido el diagnóstico temprano de múltiples malformaciones y condiciones fetales, mucha de las cuales confieren un mal pronóstico si no se intervienen de manera oportuna(13). Además de las técnicas invasivas de diagnóstico conocidas tradicionalmente como la amniocentesis, la biopsia de vellosidades coriales y la cordocentesis, se han desarrollado procedimientos más complejos para lograr este último objetivo, como la cirugía endoscópica fetal conocida como fetoscopia(13).
La terapia fetal con láser se utilizó por primera vez en embarazos MCBA complicados con STFF y la secuencia TRAP. La técnica original fue inicialmente descrita por De Lia en la década de los años 80. En 1985, De Lia público el reporte de un caso de STFF tratado con digoxina(14), en el cual ambos fetos sobrevivieron, pero el feto hidrópico presentó secuelas neurológicas. Al examinar la placenta, encontró solo una anastomosis vascular entre los dos territorios placentarios. De este caso le surgió la idea del bloqueo de las anastomosis placentarias para el manejo de esta patología(14). En el año 1985, publicó las bases teóricas de sus afirmaciones(15), y fue hasta el año de 1990 cuando De Lia y su grupo publican la aplicación de la técnica en 3 casos de STFF de 18, 22 y 22,5 semanas, de los cuales 4 fetos sobrevivieron(16).
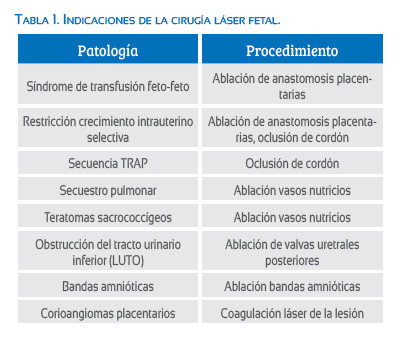
En el año 1995, Ville(17) compartió su experiencia de 45 cirugías fetales en embarazos gemelares MCBA entre las 15 y las 28 semanas(17), realizando un abordaje percutáneo mínimamente invasivo mediante guía ecográfica, haciendo la técnica menos invasiva y modificando el abordaje de Lia, el cual realizo sus primeros procedimientos mediante laparotomía(16). Ville sugirió además en su publicación que la membrana divisoria entre los dos gemelos podría servir de reparo para identificar las anastomosis vasculares que deben ser coaguladas durante el procedimiento(17). Años después, Quintero y colaboradores aparecen en la historia de la cirugía láser fetal describiendo la técnica de coagulación selectiva de vasos placentarios. Además de su uso en el STFF y la secuencia TRAP, otras indicaciones para la cirugía fetal con láser son la RCUIS, el síndrome de banda amniótica, los corioangiomas placentarios, las obstrucciones del tracto urinario inferior (LUTO), los teratomas sacroccocígeos y las masas pulmonares (tabla 1).
Aspectos generales de la técnica
El procedimiento se efectúa bajo anestesia general, regional o sedación. Es de anotar que las técnicas anestésicas se han modificado y en la actualidad la mayoría de los centros de terapia fetal indican anestesia regional o sedación como primera elección. Algunos centros utilizan incluso anestesia local con lidocaína, infiltrando la serosa uterina bajo visualización ecográfica(18). En nuestro centro, realizamos el procedimiento bajo anestesia regional o general según aplique.
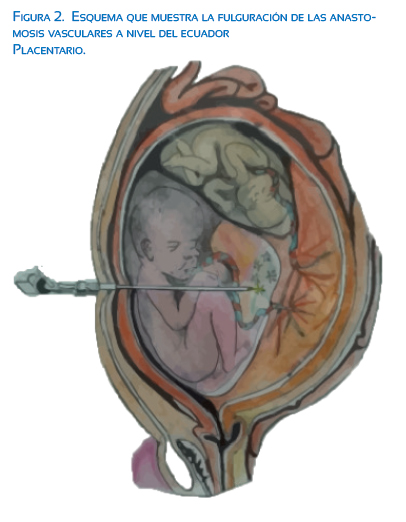
Se hace una pequeña incisión en la piel, a través de la cual se inserta un fetoscopio con cánulas de 2 a 4 mm y fibras láser de menor calibre(6). Todo el procedimiento es realizado bajo visualización ecográfica, lo cual permite guiar los movimientos del fetoscopio dentro de la cavidad amniótica y definir los sitios precisos a ser intervenidos(6); además, permite monitorizar la función cardiaca de los fetos durante el procedimiento(19). Durante la ecografía se localiza la placenta, la membrana amniótica y, mediante la utilización del Doppler color, se localiza la inserción placentaria de los cordones y algunas conexiones vasculares de la placa coriónica(17). El lugar de ingreso en el abdomen materno es de capital importancia y se debe definir previo al inicio de la cirugía. Esta área debe estar libre de placenta, lo cual facilita la visualización de esta y sus conexiones vasculares. En los casos de placenta posterior con polihidramnios, es más fácil encontrar un área segura para la inserción del trocar y, en aquellos en los cuales la placenta es anterior, el riesgo de septotomía y lesión placentaria aumenta(18). Se han descritos múltiples estrategias para abordar esta limitación técnica, como el uso de fetoscopios curvos o angulados(18). Se debe tener en cuenta a la hora de describir los aspectos técnicos de la cirugía láser fetal, que esta se realiza en un medio acuoso dado por la presencia de líquido amniótico en la cavidad uterina, razón por la cual un láser de CO2 no es efectivo debido a la absorción de este por el agua. Los láser de diodo y neodimio se pueden utilizar de manera segura a través de una fibra de 400 a 600 µm la cual se inserta a través del canal operativo del fetoscopio para la ablación láser de los vasos identificados como causantes problema según el diagnóstico prequirúrgico(6) (figura 2).
La fotocoagulación láser, como todos los procedimientos quirúrgicos, no está exento de complicaciones. La disrupción de las membranas durante el procedimiento genera riesgo de rotura prematura de membranas. Algunas de las complicaciones descritas son corioamnionitis, rotura prematura de membranas, trabajo de parto pretérmino y muerte fetal(20).
Uso de la cirugía fetal láser en complicaciones de los embarazos gemelares Monocoriales biIamnióticos: síndrome de transfusión feto-feto y restricción del crecimiento intrauterino selectiva
Síndrome de transfusión feto-feto
El diagnóstico del STFF se basa en la evidencia ecográfica de un embarazo gemelar MCBA con la secuencia oligohidramnios/polihidramnios; el bolsillo máximo vertical es menor de 2 cm y mayor de 8 cm, en el gemelo donante y receptor, respectivamente. Quintero propuso una clasificación de la enfermedad en 5 etapas con base en los hallazgos ecográficos en modo 2D y el Doppler pulsado(21).
-
Estadio I: criterios de STFF con vejiga visible en el feto donante durante toda la ecografía.
-
Estadio II: no se identifica la vejiga en el feto donante.
-
Estadio III: alteración Doppler en cualquiera de los 2 gemelos.
-
Flujo diastólico reverso o ausente en la arteria umbilical del gemelo donante.
-
Flujo diastólico reverso o ausente en la arteria umbilical, flujo reverso durante la contracción atrial en el ductus venoso, y/o vena umbilical pulsátil en general receptor.
-
Estadio IV: hidrops fetal en cualquiera de los 2 gemelos, con signos evidentes de insuficiencia cardíaca (generalmente el gemelo receptor).
-
Estadio V: muerte de uno o ambos fetos(21).
La coagulación láser de las anastomosis placentarias es el tratamiento de primera línea para los embarazos gemelares MCBA complicados con STFF antes de las 26 semanas(6). Existe controversia en la literatura con relación al manejo del estadio I(22); los resultados del metaanálisis publicado por Rossi, en 2013(23), hallan una sobrevida de 86% en los casos sometidos a manejo conservador, 77% en los casos sometidos a amniorreducción y 85% de los casos sometidos a fotocoagulación. Un metaanálisis reciente publicado por Khalil, en el año 2016(24), concluyó que la sobrevida de ambos gemelos o al menos uno de ellos en el manejo expectante fue de 70% y 87%, respectivamente; en el caso del grupo sometido a amniorreducción, fue 67% y 86%, respectivamente; mientras que en los casos sometidos a terapia láser fue 54% y 81%, respectivamente. A pesar de lo anterior, la mejoría en los resultados actuales, con sobrevida de 70% en ambos fetos y 90% en al menos uno de los fetos(25), aunado a los resultados de la North American Fetal Therapy Network (NAFTNET)(26) -en los cuales el estadio I del STFF se asoció con alto porcentaje de progresión (60%) y que la intervención mediante cirugía láser se asoció con un menor riesgo de pérdida fetal (p = 0,01)-, hacen razonable la intervención mediante fetoscopia láser de todos los estadios del STFF.
Desde la introducción de la coagulación láser para el tratamiento del STFF hasta el año 2015, se reportaron aproximadamente 4 000 procedimientos a nivel mundial(27). En la revisión sistemática de la literatura publicada por Akkermans, se encontró un incremento en sobrevida en los últimos 25 años de ambos gemelos de 35% a 65% (p = 0,012) y de al menos uno de los fetos de 70% a 88% (p = 0,009)(27).
En el artículo original publicado en el año 2017 por Diehl, acerca de 1 020 cirugías fetales láser, se describió un incremento clínicamente significativo en la sobrevida de los dos fetos de 50% a 70%, con sobrevida de uno de los fetos en 92% de los casos(28).
El neurodesarrollo es uno de los resultados perinatales más importantes, ya que impacta sobre la calidad de vida del paciente y su familia. Durante la vida fetal, el STFF está asociado con múltiples riesgo para el cerebro en desarrollo(25,29). En los fetos sin tratamiento se producen lesiones cerebrales por isquemia o hemorragia en 9% de los casos(25). En la revisión sistemática publicada por Jeanine, en el año 2013, se realizó un análisis de las lesiones cerebrales posterior a la terapia con láser versus amniorreducción, incluyendo 4 estudios que involucraron 357 niños en el grupo de amniorreducción y 269 en el grupo de terapia láser(30) Las lesiones cerebrales en los nacidos vivos del grupo de amniorreducción, fue 7 veces más alta que en los neonatos del grupo láser (IC95% 2,8 a 20). Los infantes del grupo de amniorreducción tuvieron un notable incremento de las lesiones neurológicas (RR 3,23; IC95%: 1,45 a 7,14)(30). Además, la edad gestacional al momento del nacimiento fue significativamente menor en el grupo de amniorreducción (de 28 a 31 versus 32 a 34 en el grupo de cirugía láser)(30).
En cuanto a la técnica, desde la descripción del procedimiento han surgido cambios en los métodos de coagulación. Inicialmente se coagulaban todos los vasos que cruzaban la membrana divisoria (no selectiva), lo cual compromete muchos vasos que no están implicados en las anastomosis, disminuyendo el territorio vascular y aumentando el riesgo de muerte fetal(6). Quintero(31) describió la técnica de coagulación selectiva en busca de reducir la hipotensión del gemelo donante. En el año 2009, Nataka y col(32) modificaron esta técnica cambiando el orden de coagulación de las anastomosis. La técnica láser que coagula la superficie de la placa coriónica entre las principales anastomosis a lo largo del ecuador placentario, conocida como técnica de Solomon(2,33,34), se coagula una línea a través del ecuador vascular placentario después de la ablación selectiva, en busca de separar los territorios placentarios de cada gemelo, con el objetivo de disminuir las tasas de recurrencia(2).
En una revisión sistemática publicada en 2015 por Dhillon, cuyo objetivo fue comparar la literatura disponible en cuanto a la técnica de Solomon versus la técnica selectiva, encontró evidencia estadísticamente significativa que sugiere mejor sobrevida global de al menos uno de los gemelos con la técnica de Solomon; además, una tendencia hacia la reducción de la secuencia anemia-policitemia, sin incremento de complicaciones o efectos adversos cuando se usó la técnica de Solomon comparada con la técnica selectiva(35). Se requieren más estudios aleatorizados para encontrar diferencias respecto a mortalidad, sobrevida y morbilidad a largo plazo, sobre todo alteraciones del neurodesarrollo entre las dos técnicas(2).
Cirugía fetal láser en restricción selectiva del crecimiento intrauterino
La restricción selectiva del crecimiento intrauterino afecta aproximadamente a 10 o 15% de los embarazos gemelares MCBA. Su presentación de forma temprana está asociada con mayor riesgo de muerte intrauterina y resultados neurológicos adversos en ambos fetos(36). Esta complicación propia de los embarazos MCBA, se caracteriza por la presencia de restricción del crecimiento intrauterino en uno de los fetos, sin signos de STFF(36). Se produce por una distribución inequitativa de los territorios placentarios, a menudo asociado a inserción excéntrica o velamentosa del cordón. El número y el tipo de anastomosis placentarias determinan el comportamiento clínico de esta patología(36).
Los casos con alto flujo sanguíneo entre ambos fetos tienen expresiones menos severas de la patología, mientras que las placentas con pocas anastomosis y poco flujo entre los fetos generalmente se asocian a cuadros más severos. Múltiples criterios diagnósticos han sido propuestos para el diagnóstico de la RCIUS, como el peso fetal estimado menor al percentil 10 en uno de los fetos, la discordancia de peso entre ambos fetos mayor al 25% y la discordancia de perímetros abdominales. La discordancia de peso es definida por una diferencia entre los pesos de ambos fetos igual o mayor al 25%, calculada mediante la fórmula [(peso en g del feto mayor peso en g del feto menor) / peso del feto mayor x 100](36).
La definición más ampliamente aceptada es que uno de los fetos está creciendo por debajo del percentil 10 para la edad gestacional, con una discordancia de pesos del 25% o mayor(37).
Las características del Doppler de la arteria umbilical en el feto con restricción determina la clasificación de la RCIUS en tres tipos: tipo I, Doppler de la arterial umbilical normal; tipo II, flujo diastólico de la arteria umbilical reverso o ausente de manera persistente; este subtipo está asociado con un deterioro temprano del feto con restricción; tipo III, flujo diastólico de la arteria umbilical reverso o ausente de forma intermitente; el tipo III se asocia a muerte fetal súbita o daño neurológico en uno o ambos fetos(36).
En una revisión sistemática de la literatura publicada por Buca y col, en el año 2017, que incluyó 13 estudios (610 embarazos gemelares MCBA) en pacientes con diagnóstico de RCIUS, encontraron resultados adversos en 4,8% de las RCIUS clasificadas como tipo I, 23% en el tipo II y 16% en el tipo III. Los embarazos complicados con RCIUS tipo II tuvieron un alto riesgo de mortalidad perinatal (16%), comparados con las RCIUS tipo I (4%), pero similar mortalidad perinatal que el tipo III (12%)(10).
En cuanto al manejo, se han descrito el manejo expectante, la ablación láser de vasos placentarios y la oclusión del condón del feto con restricción(38).
Las guías de la ISUOG sobre el rol del ultrasonido en el embrazo gemelar, publicadas en el año 2016, resaltan que existe evidencia limitada para guiar el manejo de los embarazos gemelares MCBA con diagnóstico de RCIUS(37).
De la misma manera, el Colegio Real de Obstetras y Ginecólogos (RCOG) en su guía Management of monochorionic twin pregnancy publicada en el mismo año, afirma que debido a que no hay evidencia de alta calidad disponible, no hay recomendaciones claras sobre el manejo de la RCIUS(39).
Con base a lo recomendado en las diferentes publicaciones, los embarazos complicados con RCIUS deben tener seguimiento ecográfico semanal por medicina materno fetal(38,39).
En general, después de las semanas 26 a 28, el riesgo de parto pretérmino es menor que el riesgo de una intervención fetal, dependiendo de los recursos disponibles para cuidados neonatales(40) Solo los casos diagnosticados antes del tercer trimestre y con alto riesgo de muerte neonatal son candidatos para intervención fetal.
En los casos con riesgo de muerte fetal in útero y por ende de secuelas en neurológicas en el otro gemelo, la oclusión del cordón del gemelo con RCIU es una opción de manejo. La sobrevida del gemelo con crecimiento normal después de la oclusión selectiva del feto afectado en casos de RCIUS tipo II es de 87 a 90%, con una tasa de sobrevida del 43 al 45%(41).
Un estudio prospectivo reciente, publicado en 2016, que tenía como objetivo describir los resultados perinatales en embarazos gemelares MCBA sometidos a oclusión de cordón en 120 casos de RCIUS tipo II y III, encontró que este procedimiento se asoció a parto por encima de las 32 semanas en 92% de los casos y sobrevida en 93% de los fetos con crecimiento normal(42).
Se ha propuesto beneficios teóricos de la fotocoagulación láser en el manejo de la RCIUS, como lograr la separación de las circulaciones fetales y proteger al gemelo con crecimiento normal de las secuelas neurológicas en caso de muerte del gemelo con RCIUS, sin sacrificar la vida de este último. Sin embargo, las anastomosis no son la causa del problema y, por el contrario, pueden ser protectoras en el gemelo con RCIUS(40).
La realización de la cirugía láser fetal en la RCIUS es técnicamente difícil, debido a que no hay polihidramnios -a diferencia del STFF-, lo cual facilita la identificación del ecuador placentario(43). En un estudio publicado en 2008 sobre los resultados perinatales en casos de RCIUS tipo III sometidos a coagulación láser de las anastomosis, solo 88,9% de los procedimientos se completaron y el 12,5% de los casos requirió una segunda intervención(43). La edad de finalización de la gestación entre los casos sometidos a manejo expectante y los sometidos a coagulación laser no tuvo significancia estadística(43).
Una revisión sistemática de la literatura que incluyó 15 estudios observacionales con un total de 784 embarazos, publicada este año por Rosemary Townsend(3) con el objetivo de recopilar la evidencia disponible con relación a los resultados de los embarazos gemelares MCBA complicados con RCIUS de acuerdo al manejo, encontró que los casos clasificados como tipo I sometidos a manejo expectante presentaron muerte intrauterina en 3,1% de los casos; en los tratadas con láser, ocurrió muerte fetal en el 16% de los casos (IC95% 0,4 a 64,1), y en los sometidos a oclusión de cordón, no se presentó muerte del gemelo con crecimiento normal en ninguno de los casos; además, no se documentaron secuelas neurológicas en este último grupo. En los casos de RCIUS tipo II sometidos a manejo expectante ocurrió muerte fetal en el 16% de los casos (IC95% 6,9 a 29,5) y muerte neonatal en 6,4% (IC95% 0,2 a 28,2); el 89% de los gemelos sobrevivientes no presentaron secuelas neurológicas. En el grupo de terapia láser, ocurrió muerte intrauterina en 44,3% (IC95% 22,2 a 67,7) de los casos; los sobrevivientes no presentaron secuelas neurológicas. En los embarazos sometidos a reducción fetal en este grupo, ocurrió muerte fetal del otro gemelo en 5% de los casos (IC95% 0,03 a 20,5), muerte neonatal en 3,7% (IC95% 0,2 a 11,1), y el 90% (IC95% 42,3 a 94,3) de los fetos sobrevivientes no presentó secuelas neurológicas(3).
En el grupo de RCIUS tipo III en manejo expectante, se presentó muerte fetal en 13,2% (IC95% 7,2 a 20,5), muerte neonatal en 6,8% (IC95% 0,7 a 18,6), y el 61% (IC95% 38,4 a 81,9) de los sobrevivientes no presentó secuelas neurológicas. En los casos tratados con láser, hubo muerte en 32,9% de los casos (IC95% 20,9 a 46,2) y todos los sobrevivientes no presentaron secuelas neurológicas. Finalmente, los casos tratados con oclusión de cordón en este grupo, el 5,2% (IC95% 0,8 a 12,8) devino en muerte neonatal del otro gemelo, y el 98% (IC95% 93,9 a 99,9) de los sobrevivientes no presentó secuelas(3). Concluyeron que el RCIS tipo I muestra un buen pronóstico
con manejo expectante, el cual se constituye en el manejo más razonable para este subgrupo de pacientes.
Los MCBA afectados con RCIUS tipo II y III tratados con fetoscopia láser tuvieron alta mortalidad, pero baja morbilidad neurológica, comparados con los que recibieron manejo expectante, soportando el uso de esta terapia en gestaciones lejos de la viabilidad fetal. Sin embargo, ante la carencia de alta calidad proveniente de estudios controlados aleatorizados, el manejo debe ser individualizado de acuerdo a la edad gestacional, la severidad y las alteraciones en la evaluación Doppler(3).
Discusión
Los embarazos gemelares están asociados a altas tasas de todas las complicaciones del embarazo; aportan aproximadamente el 3% de todos los nacimientos, son responsables del 6,3% de las muertes fetales y 12% de las muertes neonatales(1). El embarazo gemelar monocorial biamniótico (MCBA) corresponde a aproximadamente 15% de los embarazos gemelares(2) y, de estos, se estima que entre 10 y 15% desarrollan complicaciones propias de este tipo de embarazos, como la restricción selectiva del crecimiento intrauterino (RCIUS)(3) y el síndrome de transfusión feto (STFF)(5,6).
El STFF y la RCIUS comparten en común mecanismos fisiopatológicos derivados de la interdependencia de los fetos a través de conexiones vasculares placentarias(3).
La muerte de uno de los fetos por cualquier etiología en el segundo y tercer trimestre en los embarazos MCBA, produce un riesgo significativo de morbilidad neurológica, con hallazgos anormales en las neuroimágenes en 34% de los fetos sobrevivientes(11).
La visualización mediante fetoscopia y la cirugía fetal laser permiten tratar la causa de estas alteraciones hemodinámicas propias de los embarazos MCBA a través de la coagulación de las anastomosis placentarias, y es considerada actualmente la terapia de elección en el STFF y aplicable en algunos casos de RCIUS(2).
Desde la introducción de la coagulación láser para el tratamiento del STFF hasta el año 2015, se reportaron aproximadamente 4 000 procedimientos a nivel mundial(27). En la revisión sistemática de la literatura publicada por Akkermans, encontraron un incremento en la sobrevida en los últimos 25 años de ambos gemelos de 35% a 65% (p = 0,012) y de al menos uno de los fetos de 70% a 88% (p = 0,009)(27).
En el STFF, la coagulación láser de las anastomosis placentarias es el tratamiento de primera línea antes de las 26 semanas(6); es de anotar que en algunos centros de cirugía fetal de América Latina, la edad límite para realizar el procedimiento se fija en cada caso en particular y depende del resultado neonatal de las unidades de cuidado intensivo de cada hospital especifico. Existe controversia en la literatura con relación al manejo del estadio I; sin embargo, la mejoría en los resultados actuales, con sobrevida de 70% en ambos fetos y de 90% en al menos uno de los fetos(25), aunado a los resultados de la North American Fetal Therapy Network(26), en los cuales el estadio I del STFF se asoció con alto porcentaje de progresión (60%) y a menor riesgo de pérdida fetal (p = 0,01) en los casos sometidos a cirugía láser, hacen razonable la intervención mediante fetoscopia láser de todos los estadios del STFF. Estudios previos de Molina(22) mostraron cómo en centros de cirugía fetal con experiencia, la terapia de elección para estadio I es el láser feto placentario.
En el artículo original publicado en el año 2017 por Diehl, acerca de 1 020 cirugías fetales láser, se reportó un incremento clínicamente significativo en la sobrevida de los dos fetos de 50% a 70%, con sobrevida de uno de los fetos en 92% de los casos(28).
El neurodesarrollo es uno de los resultados perinatales más importantes, ya que impacta sobre la calidad de vida del paciente y su familia. En los fetos sin tratamiento se producen lesiones cerebrales por isquemia o hemorragia en 9% de los casos. En cuanto a la técnica utilizada para la intervención del STFF, la revisión sistemática publicada en 2015 por Dhillon, en la cual se comparó la literatura disponible en cuanto a la técnica de Solomon versus la técnica selectiva, encontró evidencia estadísticamente significativa que sugiere mejor sobrevida global de al menos uno de los gemelos con la técnica de Solomon; además, una tendencia hacia la reducción de la secuencia anemia policitemia, sin incremento de complicaciones o efectos adversos cuando se usó la técnica de Solomon, comparada con la técnica selectiva(35).
La restricción selectiva del crecimiento intrauterino afecta a aproximadamente 10 a 15% de los embarazos gemelares MCBA. La evidencia disponible sobre el uso y la efectividad de la terapia láser en la RCIUS es más limitada comparada con el STFF. Las guías de la ISUOG sobre el rol del ultrasonido en el embrazo gemelar publicadas en el año 2016, resaltan que existe evidencia limitada para guiar el manejo de los embarazos gemelares MCBA con diagnóstico de RCIUS(37). En este mismo sentido, el Colegio Real de Obstetras y Ginecólogos (RCOG) en su guía Management of monochorionic twin pregnancy publicada en el mismo año, se afirma que, debido a que no hay evidencia de alta calidad disponible, no hay recomendaciones claras sobre el manejo de la RCIUS(39).
En general, después de las semanas 26 a 28, el riesgo de parto pretérmino es menor que el riesgo de una intervención fetal, dependiendo de los recursos disponibles para cuidados neonatales(40). Solo los casos diagnosticados antes del tercer trimestre y con alto riesgo de muerte neonatal son candidatos para intervención fetal(40).
La revisión sistemática publicada por Rosemary Townsend(3) con el objetivo de recopilar la evidencia disponible con relación a los resultados de los embarazos gemelares MCBA complicados con RCIUS de acuerdo al manejo, concluyeron que el RCIS tipo I presenta un buen pronóstico con manejo expectante, el cual se constituye en la conducta más razonable para este subgrupo de pacientes. Los MCBA afectados con RCIUS tipo II y III tratados con fetoscopia láser tuvieron alta mortalidad, pero baja morbilidad neurológica, comparados con los que recibieron manejo expectante, respaldando el uso de esta terapia en gestaciones lejos de la viabilidad fetal. Sin embargo, ante la carencia de alta calidad proveniente de estudios controlados aleatorizados, el manejo debe ser individualizado de acuerdo a la edad gestacional, la severidad y las alteraciones en la evaluación Doppler(3).
Conclusión
Las complicaciones propias de los embarazos gemelares MCBA son una causa importante de morbimortalidad fetal sin diagnóstico, seguimiento y manejo adecuado. La presente revisión evidencia que la fetoscopia con ablación láser de vasos comunicantes placentarios es la técnica de elección en los casos de síndrome de transfusión feto fetal. El uso de dicha terapia para los casos de restricción de crecimiento intrauterino selectivo no ha mejorado la sobrevida y se guarda solo para casos seleccionados en los cuales el beneficio debe ser evaluado por los integrantes de un grupo de especialistas en medicina materno fetal, terapia y cirugía fetal con experiencia.
Conflictos de interés: No hay
Financiamiento: No existió para el presente artículo
Citar como: Molina-Giraldo S, HincapiéPorras C. Cirugía fetal láser en síndrome de transfusión feto feto y restricción selectiva del crecimiento intrauterino. Rev Peru Ginecol Obstet. 2018;64(4): 587-597 DOI: https://doi.org/10.31403/rpgo.v64i2128
Referencias Bibliográficas
1. Ferriman E, Stratton S, Stern V. Twin pregnancy. Obstet Gynaecol Reprod Med [Internet]. 2018;28(8):221– 8. Available from: https://doi.org/10.1016/j.ogrm.2018.07.002 [ Links ]
2. Molina-Giraldo S , Casas R, Ortiz R. Resultados perinatales en el síndrome de transfusión feto fetal manejados con la técnica de Solomon. Rev Chil Obs Ginecol. 2016;81(3):234–42. [ Links ]
3. Townsend R, D’Antonio F, Sileo FG, Kumbay H, Thilaganathan B, Khalil A. Perinatal outcome of monochorionic twin pregnancies complicated by selective fetal growth restriction according to management: a systematic review and meta-analysis. Ultrasound Obstet Gynecol [Internet]. 2018; Available from: http://doi.wiley.com/10.1002/uog.20114
4. Molina-Giraldo S, Aramediz JM, Beltrán SL, Rojas-Arias JL, Acuña-Osorio E, Solano-Montero AF. Resultado perinatal de embarazos gemelares atendidos en dos instituciones de alta complejidad en Bogotá, Colombia. Rev Chil Obstet Ginecol. 2015;80(1):18–23. [ Links ]
5. Delabaere A, Leduc F, Reboul Q, Fuchs F, Wavrant S, Dubé J, et al. Factors associated to early intrauterine fetal demise after laser for TTTS by preoperative fetal heart and Doppler ultrasound. Prenat Diagn. 2018;38(7):523–30. [ Links ]
6. Sago H, Ishii K, Sugibayashi R, Ozawa K, Sumie M, Wada S. Fetoscopic laser photocoagulation for twin– twin transfusion syndrome. J Obstet Gynaecol Res. 2018;44(5):831–9. [ Links ]
7. Mackie FL, Hall MJ, Morris RK, Kilby MD. Early prognostic factors of outcomes in monochorionic twin pregnancy: systematic review and meta-analysis. Am J Obstet Gynecol [Internet]. 2018;1–11. Available from: https://doi.org/10.1016/j.ajog.2018.05.008 [ Links ]
8. Molina-Giraldo S, Solano-Montero AF, Santana-Corredor NL, Ortega C, Alfonso-Ayala DA. Resultados perinatales en embarazos múltiples monocoriales relacionados con las características placentarias. Ginecol Obstet Mex. 2017;85(2):80–91. [ Links ]
9. Miyadahira M, Brizot M, Carvalho M, Biancolin S, Machado R, Krebs V, et al. Type II and III Selective Fetal Growth Restriction: Perinatal Outcomes of Expectant Management and Laser Ablation of Placental Vessels. Clinics [Internet]. 2018;73:1–5. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5902759/?report=classic [ Links ]
10. Buca D, Pagani G, Rizzo G, Familiari A, Flacco ME, Manzoli L, et al. Outcome of monochorionic twin pregnancy with selective intrauterine growth restriction according to umbilical artery Doppler flow pattern of smaller twin: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2017;50(5):559–68. [ Links ]
11. Mackie FL, Morris RK, Kilby MD. Fetal Brain Injury in Survivors of Twin Pregnancies Complicated by Demise of One Twin: A Review. Twin Res Hum Genet. 2016;19(3):262–7. [ Links ]
12. Sala P, Prefumo F, Pastorino D, Buffi D, Gaggero CR, Foppiano M, et al. Fetal surgery: An overview. Obstet Gynecol Surv. 2014;69(4):218–28. [ Links ]
13. Mathis J, Raio L, Baud D. Fetal laser therapy: Applications in the management of fetal pathologies. Prenat Diagn. 2015;35(7):623–36. [ Links ]
14. De Lia J, Emery MG, Sheafor SA, Jennison TA. Twin transfusion syndrome: successful in utero treatment with digoxin. Int J Gynaecol Obstet [Internet]. 1985 Jun;23(3):197–201. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2865181 [ Links ]
15. De Lia JE. Treatment of placental vasculature with a neodymium-yttrium-aluminum-garnet laser via fetoscopy. Am J Obstet Gynecol. 1985;151(8):1126–7. [ Links ]
16. De Lia JE, Cruikshank DP, Keye WR. Fetoscopic neodymium:YAG laser occlusion of placental vessels in severe twin-twin transfusion syndrome. Obstet Gynecol [Internet]. 1990 Jun;75(6):1046–53. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2342732 [ Links ]
17. Ves Y, Ille V, On J, Yett H, Urt K, Echer H, et al. Preliminary Experience With Endoscopic Laser Surgery for Severe Twin–Twin Transfusion Syndrome. 1995;224–7. [ Links ]
18. Chang YL. Fetoscopic guide laser therapy for twin-twin transfusion syndrome. Gynecol Minim Invasive Ther [Internet]. 2013;2(1):8–12. Available from: http://dx.doi.org/10.1016/j.gmit.2012.12.002 [ Links ]
19. Papanna R, Mann LK, Molina-Giraldo S, Johnson A, Moise KJ. Changes in the recipient fetal Tei index in the peri-operative period after laser photocoagulation of placental anastomoses for twin-twin transfusion syndrome. Prenat Diagn [Internet]. 2011 Feb;31(2):176–80. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21268037 [ Links ]
20. Papanna R, Molina-Giraldo S, Moise KY, Moise KJ, Johnson A. Chorioamnion plugging and the risk of preterm premature rupture of membranes after laser surgery in twin-twin transfusion syndrome. Ultrasound Obstet Gynecol. 2010;35(3):337–43. [ Links ]
21. Quintero RA, Morales WJ, Allen MH, Bornick PW, Johnson PK, Kruger M. Staging of twin-twin transfusion syndrome. J Perinatol [Internet]. 1999;19(8 Pt 1):550–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10645517 [ Links ]
22. Molina-Giraldo S, Papanna R, Moise KJ, Johnson A. Management of stage I twin-to-twin transfusion syndrome: An international survey. Ultrasound Obstet Gynecol. 2010;36(1):42–7. [ Links ]
23. Rossi AC, D’Addario V. Survival outcomes of twin-twin transfusion syndrome stage I: A systematic review of literature. Am J Perinatol [Internet]. 2013;30(1):5–10. Available from: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84873412345&partnerID=40&md5=ee22dadb5814843bc9459f38c7c78e4c
24. Khalil A, Cooper E, Townsend R, Thilaganathan B. Evolution of Stage 1 Twin-to-Twin Transfusion Syndrome (TTTS): Systematic Review and Meta-Analysis. Twin Res Hum Genet. 2016;19(3):207–16. [ Links ]
25. Hecher K, Gardiner HM, Diemert A, Bartmann P. Longterm outcomes for monochorionic twins after laser therapy in twin-to-twin transfusion syndrome. Lancet Child Adolesc Heal [Internet]. 2018;2(7):525–35. Available from: http://dx.doi.org/10.1016/S23524642(18)30127-5 [ Links ]
26. Emery SP, Hasley SK, Catov JM, Miller RS, Moon-Grady AJ, Baschat AA, et al. North American Fetal Therapy Network: intervention vs expectant management for stage I twin-twin transfusion syndrome. Am J Obstet Gynecol [Internet]. 2016;215(3):346.e1-346.e7. Available from: http://dx.doi.org/10.1016/j.ajog.2016.04.024 [ Links ]
27. Akkermans J, Peeters SHP, Klumper FJ, Lopriore E, Middeldorp JM, Oepkes D. Twenty-Five Years of Fetoscopic Laser Coagulation in Twin-Twin Transfusion Syndrome: A Systematic Review. Fetal Diagn Ther. 2015;38(4):241–53. [ Links ]
28. Diehl W, Diemert A, Grasso D, Sehner S, Wegscheider K, Hecher K. Fetoscopic laser coagulation in 1020 pregnancies with twin-twin transfusion syndrome demonstrates improvement in double-twin survival rate. Ultrasound Obstet Gynecol [Internet]. 2017 Dec;50(6):728–35. Available from: http://www.ncbi. nlm.nih.gov/pubmed/28477345 [ Links ]
29. Ishii K, Wada S, Takano M, Nakata M, Murakoshi T, Sago H. Survival Rate without Brain Abnormalities on Postnatal Ultrasonography among Monochorionic Twins after Fetoscopic Laser Photocoagulation for Selective Intrauterine Growth Restriction with Concomitant Oligohydramnios. Fetal Diagn Ther. 2018;1101. [ Links ]
30. Van Klink JMM, Koopman HM, Van Zwet EW, Oepkes D, Walther FJ, Lopriore E. Cerebral injury and neurodevelopmental impairment after amnioreduction versus laser surgery in twin-twin transfusion syndrome: A systematic review and meta-analysis. Fetal Diagn Ther. 2013;33(2):81–9. [ Links ]
31. Quintero RA, Morales WJ, Mendoza G, Allen M, Kalter CS, Giannina G, et al. Selective photocoagulation of placental vessels in twin-twin transfusion syndrome: evolution of a surgical technique. Obstet Gynecol Surv [Internet]. 1998 Dec;53(12 Suppl):S97-103. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9870237 [ Links ]
32. Nakata M, Murakoshi T, Sago H, Ishii K, Takahashi Y, Hayashi S, et al. Modified sequential laser photocoagulation of placental communicating vessels for twin-twin transfusion syndrome to prevent fetal demise of the donor twin. J Obstet Gynaecol Res. 2009;35(4):640–7. [ Links ]
33. Lopriore E, Slaghekke F, Middeldorp JM, Klumper FJ, Oepkes D, Vandenbussche FP. Residual anastomoses in twin-to-twin transfusion syndrome treated with selective fetoscopic laser surgery: localization, size, and consequences. Am J Obstet Gynecol [Internet]. 2009;201(1):66.e1-66.e4. Available from: http://dx.doi.org/10.1016/j.ajog.2009.01.010 [ Links ]
34. Moise KJ, Johnson JA, Bebbington MW, Papanna R. The "Solomon method." Ultrasound Obstet Gynecol. 2014;43(2):238–9. [ Links ]
35. Dhillon RK, Hillman SC, Pounds R, Morris RK, Kilby MD. Comparison of Solomon technique with selective laser ablation for twin-twin transfusion syndrome: a systematic review. Ultrasound Obstet Gynecol [Internet]. 2015 Nov;46(5):526–33. Available from: http://doi.wiley.com/10.1002/uog.14813 [ Links ]
36. Bennasar M, Eixarch E, Martinez JM, Gratacós E. Selective intrauterine growth restriction in monochorionic diamniotic twin pregnancies. Semin Fetal Neonatal Med. 2017;22(6):376–82. [ Links ]
37. Goya M, Carreras E, Cabero L. Re: ISUOG Practice Guidelines: role of ultrasound in twin pregnancy. Ultrasound Obstet Gynecol. 2016;48(5):669–70. [ Links ]
38. Khalil A, Thilaganathan B. Selective fetal growth restriction in a monochorionic twin pregnancy: a Dilemma for clinicians and a challenge for researchers. Ultrasound Obstet Gynecol [Internet]. 2018; Available from: http://doi.wiley.com/10.1002/uog.20093 [ Links ]
39. No GG. Management of Monochorionic Twin Pregnancy: Green-top Guideline No. 51. BJOG An Int J Obstet Gynaecol. 2017;124(1):e1–45. [ Links ]
40. Townsend R, Khalil A. Fetal growth restriction in twins. Best Pract Res Clin Obstet Gynaecol [Internet]. 2018;49:79–88. Available from: https://doi.org/10.1016/j.bpobgyn.2018.02.004 [ Links ]
41. Bebbington MW, Danzer E, Moldenhauer J, Khalek N, Johnson MP. Radiofrequency ablation vs bipolar umbilical cord coagulation in the management of complicated monochorionic pregnancies. Ultrasound Obstet Gynecol. 2012;40(3):319–24. [ Links ]
42. Parra-Cordero M, Bennasar M, Martínez JM, Eixarch E, Torres X, Gratacós E. Cord Occlusion in Monochorionic Twins with Early Selective Intrauterine Growth Restriction and Abnormal Umbilical Artery Doppler: A Consecutive Series of 90 Cases. Fetal Diagn Ther. 2016;39(3):186–91. [ Links ]
43. Gratacós E, Antolin E, Lewi L, Martínez JM, Hernandez-Andrade E, Acosta-Rojas R, et al. Monochorionic twins with selective intrauterine growth restriction and intermittent absent or reversed end-diastolic flow (Type III): Feasibility and perinatal outcome of fetoscopic placental laser coagulation. Ultrasound Obstet Gynecol. 2008;31(6):669–75. [ Links ]
Correspondencia:
Saulo Molina Giraldo, M.D., MSC.
Unidad de Medicina Materno Fetal y Fetoscopia Calle 91c, 21-17, 4° Piso. Bogotá, Colombia
saulo.molina@urosario.edu.co , smolina@fucsalud.edu.co
Recibido: 1 octubre 2018
Aceptado: 3 octubre 2018