INTRODUCCIÓN
La LMC es un desorden clonal de células madre hematopoyéticas; se caracteriza por la presencia del cromosoma Filadelfia (Ph) con traducción recíproca entre los cromosomas 9 y 22, resultando en BCR-ABL, que codifica una tirosina quinasa (TK) constitutivamente activa1,2. Predomina en el sexo masculino (relación 1,6:1). La edad media al diagnóstico es de 55-65 años. El diagnóstico depende del hallazgo del cromosoma anormal Filadelfia t (9;22) (q34;q11.2)3.
El uso clínico de los inhibidores de tirosina cinasa (ITK) fueron dirigidos selectivamente al bloqueo de la actividad enzimática de BCR-ABL, siendo el imatinib el primer fármaco disponible4. La necesidad de mejorar las terapias existentes, dieron origen a una segunda generación de ITK, con fármacos como dasatinib. El dasatinib es 325 veces más potente que el imatinib. La FDA aprobó el uso de este fármaco para el tratamiento de LMC en pacientes positivos al cromosoma Filadelfia5,6. El dasatinib inhibe múltiples TK, incluyendo BCR-ABL1, receptor β del factor de crecimiento derivado de plaquetas y quinasas de la familia Src7,8. Las reacciones adversas del dasatinib fueron descubiertas durante estudios clínicos que condujeron a su aprobación. Desde el ensayo clínico de fase 1 se observó toxicidades de grado 3 y 4. En el ensayo clínico DASISION de fase III (2016), se reportó derrame pleural (asociado a presiones arteriales pulmonares elevadas) en un 28% de los casos y 14 (5%) pacientes presentaron HAP9-11.
La Hipertensión Pulmonar (HP) resulta de la restricción al flujo en la circulación de la arteria pulmonar, culminando en falla cardiaca derecha. Se caracteriza por una mPAP ≥25 mmHg en reposo (normal en reposo de 14 ± 3). Los pacientes que se presentan en rango de mPAP entre 21-24 mmHg deben ser seguidos cuando estén en riesgo de desarrollar HAP12,13. La HAP inducida por ITK tiene una incidencia baja y la dosis de dasatinib no parece estar correlacionado con el riesgo de desarrollar HAP14.
Respecto al mecanismo de la HAP, inducida por dasatinib, se sabe que inhibe a la familia de quinasas Src que participan en la proliferación celular y regulan el tono del músculo liso de la AP por medio de la vía del canal-1 de potasio sensible a TWIK-2. Conduce a la despolarización de las células musculares lisas, vasoconstricción y aumento de la presión arterial pulmonar; al mismo tiempo, tiene una asociación indirecta con la producción de óxido nítrico y prostaglandinas responsables de la relajación vascular, por lo que al inhibir las vías de señalización Scr ocurre un desbalance entre dilatación y vasoconstricción15,16. La asociación de dasatinib con eventos arteriales mayores, se reportó en 2015 por Chai-Adisaksopha17, lo cual se relaciona a la proliferación anormal de músculo liso; Guignabert et al.18en el año 2016 propusieron que el dasatinib causa disfunción celular endotelial pulmonar, remodelación e hipertensión pulmonar.
En el diagnóstico de la HAP por ecocardiografía, el cateterismo cardiaco derecho es la técnica de elección, siendo un procedimiento invasivo con múltiples complicaciones. Debido a que los síntomas de HAP son inespecíficos y los signos físicos sutiles, el diagnóstico suele ser tardío y en etapas avanzadas de la enfermedad, por esta razón es necesario contar con técnicas no invasivas y de bajo riesgo que tengan un alto índice de eficacia para detectar HAP antes de que ocurran daños fisiológicos irreversibles. Por ecocardiograma transtorácico (ECOTT) se pueden obtener signos directos e indirectos de presión arterial pulmonar (PAP) elevada, la cual tiene una utilidad para el diagnóstico y pronóstico de HAP19,20. Se utiliza el parámetro de velocidad de la regurgitación tricuspídea (VRT) para estimar la presión sistólica de la arteria pulmonar (PSAP) ya que existe buena correlación con la PAP medida por cateterismo cardiaco derecho.
El diagnóstico ecocardiográfico de HAP es probable cuando la VRT > 3,4 m/s. Es posible cuando la VTR es entre 2,9-3,4 m/s o cuando VTR ≤ 2,8 m/s con variables adicionales que sugieran HAP (dilatación cavidades derechas, hipertrofia de ventrículo derecho, dilatación del tronco de la arteria pulmonar)21,22. Por ecocardiografía con doppler color, se puede estimar la presión media de la arteria pulmonar (mPA) usando el tiempo de aceleración en el tracto de salida del ventrículo23. El uso de doppler tisular para medir la (FDVD) se considera útil y característico en la HAP. En el 2005, describen un incremento significativo del tiempo de relajación isovolumétrica (TRIV); actualmente existe validación de la correlación de TRIV con HAP, PSAP y disfunción diastólica24. En el año 2017, Skride et al.25, presentaron un reporte de caso, un hombre de 67 años con LMC tratado con dasatinib. Después del tratamiento, presentó derrame pleural; mediante ECOTT y por cateterismo cardíaco derecho se confirmó HAP grave con mPAP de 53 mmHg. Ante estos hallazgos se suspendió el dasatinib. Un estudio de seguimiento a un mes, mostró una mejoría significativa de la mPAP de 34 mmHg. En el año 2016, Morishita et al.26, presentaron reporte de una paciente con LMC a quien se le había administrado dasatinib por tres años; 34 meses después, la paciente presentó disnea de esfuerzo, no hubo un aumento del derrame pleural (que había presentado previamente); se sospechó HAP por ECOTT. Luego se confirmó HAP mediante cateterismo cardíaco
En el año 2016, Minami et al.27presentaron un análisis comparativo de HAP en pacientes tratados con diferentes inhibidores de TK; se utilizó ECOTT para evaluar la incidencia de HAP en 105 pacientes con LMC tratados con imatinib (n = 37), nilotinib (n = 30) o dasatinib (n = 38), utilizando el promedio del gradiente pico de regurgitación tricuspídea (TRPG). Un TRPG> 31 mmHg, sugirió posible HAP en nueve de 105 pacientes: uno (2,7%) tratado con imatinib, tres (10,0%) con nilotinib y cinco (13.2%) con dasatinib. Estos resultados sugirieron que el tratamiento con dasatinib, imatinib y nilotinib, puede asociarse con la HAP subclínica, concluyendo que la ecocardiografía no invasiva es útil para la detección de HAP, en pacientes tratados con TKI de segunda generación.
En 2016 Jin et al.28presentaron el caso de un hombre de 55 años con LMC tratado con dasatinib a dosis de 100 mg al día. Posterior a 36 meses de tratamiento se presenta con disnea, fatiga y edema. Se realizó ECOTT en el cual se documenta crecimiento de ventrículo y aurícula derechos, con PSAP estimada en 115 mmHg y derrame pericárdico. Presentó mejoría al suspender el tratamiento con dasatinib, documentándose reducción de PSAP 37-82 mmHg medido en tres ocasiones). En 2016 Nagasaki et al.29reportaron el caso de un hombre de 59 años, con LMC en tratamiento con por cinco años, a dosis de 100 mg al día. Presentó disnea con deterioro de clase funcional. Se realizó ECOTT encontrando datos de HAP, con PSAP de 80 mmHg y una PAPm de 29 mmhg. Se descontinuó el tratamiento, mostrando disminución de PSAP de 51 y 40 mmHg al primer mes y año respectivamente. En 2015 Hong et al.30, reportaron dos casos de pacientes con LMC tratados con dasatinib. Un caso fue un hombre de 43 años, quien tras 69 meses de tratamiento se presentó con disnea, realizándose ECOTT con PSAP de 92 mmhg, crecimiento de ventrículo y aurícula derechos, así como leve derrame pleural. El segundo caso fue un hombre de 52 años, quien presentó disnea, se realizó ECOTT con PSAP 71 mmHg, leve derrame pleural. Ambos casos presentaron mejoría y disminución de PSAP tras la suspensión de dasatinib.
El uso de dasatinib en pacientes con LMC ha mejorado la expectativa de vida; sin embargo, se ha documentado toxicidad por el fármaco (HAP) pudiendo tornarse irreversible. En etapas tempranas de HAP, la mayoría de los pacientes pueden encontrarse asintomáticos, pudiendo detectarse mediante ECOTT. Realizar un ecocardiograma es de bajo costo y se realiza en un tiempo relativamente corto. Se enfoca en medir la PSAP y hallazgos relacionados a HAP. Así mismo, es importante medir la FDVD, dado que a largo plazo se ven afectadas las cavidades cardiacas derechas. El seguimiento de los pacientes tratados con dasatinib, por medio de ECOTT es de importancia, para detección temprana de HAP y poder hacer modificaciones al tratamiento.
Por lo mencionado, el objetivo de este estudio fue determinar los parámetros ecocardiográficos útiles para el diagnóstico de a HAP en pacientes con LMC en tratamiento con dasatinib, para hacer un diagnóstico temprano y seguimiento.
MÉTODOS
Se realizó un estudio de correlación, observacional, transversal, retrospectivo, retrolectivo, unicéntrico y homodémico. El diseño y tipo de muestreo fue determinístico. Se estudiaron los pacientes del Servicio de Hematología con diagnóstico de LMC en tratamiento con dasatinib. Se incluyeron pacientes mayores de 18 años y menores de 80 años. Se excluyeron los pacientes con datos ecocardiográficos incompletos. Se obtuvo una población total de 31 pacientes, de los cuales, 15 se excluyeron por no contar con estudio ecocardiográfico en la base de trabajo.
Los datos del estudio se obtuvieron del expediente clínico y de la base de trabajo workplace syngo SC2000 localizada en el gabinete de cardiología. Se midió por ECOTT, mPAP, VmxRT, PSAP, la función diastólica del ventrículo derecho, y se determinó la probabilidad ecocardiográfica para hipertensión pulmonar; se identificó la dosis de dasatinib indicada en cada paciente, así como el tiempo de tratamiento. Se elaboró una base de datos de Excel y se estableció si existe o no HAP y que hallazgos ecocardiográficos se encuentran relacionados. Se consideró HAP a partir de mPAP mayor a 25 mmHg. Se consideraron como parámetros ecocardiográficos relacionados a HAP, una VmxRT mayor o igual a 2,8 m/s, PSAP mayor a 35 mmHg y DDVD. Los datos se analizaron con estadística descriptiva, usando medidas de tendencia central y de dispersión, utilizando pruebas estadísticas paramétricas y no paramétricas (Correlación de Spearman y de Pearson). Se realizó el análisis por medio del programa Excel versión 16.39 y SPSS versión 26. Los recursos humanos, materiales y financieros fueron proporcionados por los investigadores principales del estudio.
El estudio fue aprobado por el Comité Local de Investigación en Salud. Este estudio fue diseñado de acuerdo con el Reglamento de la ley General de Salud (reglamento de la Ley General de Salud en materia de investigación para la salud). Se apegó a las normas éticas elaboradas en Helsinki de 1972 y modificada en 1989. Se sometió a evaluación por el comité local de investigación de nuestra Unidad Médica. Se protegió la privacidad de los pacientes estudiados.
RESULTADOS
Se analizó a un total de 16 pacientes (Tabla 1y 2 para el análisis estadístico), la edad promedio fue de 53,5 años, con una DE 11,7. En cuanto el género, 10 pacientes fueron masculinos (62,5%) y seis femeninos (37,5%). Del total de pacientes, dos (12,5%) tuvieron diagnósticos de diabetes mellitus tipo 2 (DM2), hipertensión arterial crónica (HAC) y enfermedad renal crónica (ERC) concomitantes; un paciente (6,2%) tuvo ERC aislada estadio 3a, no se encontró cardiopatía isquémica ni cardiopatía estructural; 13 pacientes (81,3%) no presentaron comorbilidades. Esto es diferente al estudio publicado por Minami et al.27en el año 2017, quiénes entre las comorbilidades reportaron un paciente con cardiopatía isquémica crónica, sin reportar otras comorbilidades. Estos resultados en los pacientes estudiados fueron por la prevalencia en nuestro medio de DM2 e hipertensión y la presencia de ERC como complicación asociada a tales comorbilidades. Respecto a la dosis de dasatinib, a tres pacientes se administró 50 mg al día (18,7%), y en 13 pacientes 100 mg al día (81,2%). En cuanto mPAP, tuvo una media de 26,3 mmHg, DE 13,63. Con la variable VmxRT, se obtuvo una media de 2,9 m/s, DE 0,51. Respecto a PSAP, se obtuvo una media de 41 mmHg, DE 14,02. Del total de pacientes, nueve pacientes (56,2%) se encontraron con DDVD y siete pacientes (43,7%) con FDVD normal. En cuanto a la probabilidad para HAP, siete pacientes (43%) se categorizaron en baja probabilidad, tres pacientes (18,7%) para probabilidad intermedia, y seis pacientes (37,5%) para probabilidad alta. De los pacientes con antecedentes de DM2, HAC y ERC, dos pacientes (100%) se encontraron con HAP y DDVD, así como Vmx RT >2,8 m/s y PSAP >35 mmHg. El paciente con ERC aislada se encontró con DDVD, Vmx RT >2,8 m/s y PSAP >35 mmHg (clasificado en alta probabilidad ecocardiográfica para HAP). No se encontró en estudios previos reporte similar a los obtenidos.
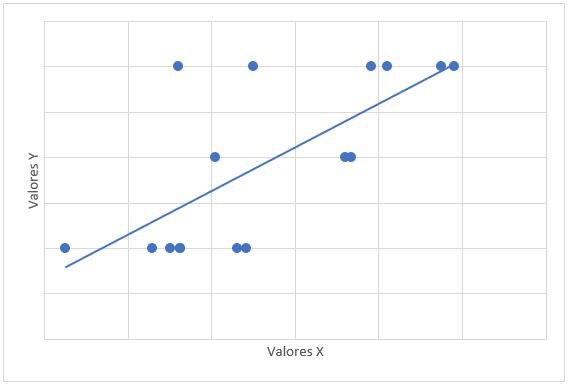
La relación entre el tiempo de tratamiento con dasatinib y las cifras de mPAP tuvo un valor de r= -0,315 con valor de p= 0,235. La relación entre mPAP y dosis de dasatinib, tuvo un valor de r=0,122 con valor de p=0,653. La relación de mPAP con PSAP, tuvo un valor de r=0,647 y valor de p=0,007 (Gráfico 1). La relación entre mPAP con VmxRT tuvo un valor de r= 0,612 y valor de p=0,012 (Gráfico 2). La relación entre mPAP y FDVD, tuvo un valor de r= 0,708 y valor de p=0,002 (Gráfico 3). La relación entre la probabilidad para HAP con mPAP, tuvo un valor de r=0,706 y valor de p=0,008 (Gráfico 4).
Tabla 1. Análisis estadístico de variables cuantitativas.
| Variables | Media | Mínimo | Máxima | Desviación estándar |
|---|---|---|---|---|
| Tiempo | 146,2 | 14,7 | 381,4 | 101,26 |
| PSAP | 41 | 18 | 70 | 14,02 |
| Vmx RT | 2,9 | 2,1 | 4.0 | 0,51 |
| mPAP | 26,3 | 2,5 | 49,1 | 13,63 |
PSAP: Presión sistólica de la arteria pulmonar, VmxRT: Velocidad máxima de regurgitación tricuspídea, PAPm: presión media de la arteria pulmonar.
Tabla 2. Análisis estadístico de variables cuantitativas:dosis dasatinid, FDVD y probabilidad para HAP.
| Dosis de dasatinib | No. pacientes | Porcentaje | Razón | Tasa | Error de muestreo | Intervalo de confianza al 95% |
|---|---|---|---|---|---|---|
| 50 mg | 3 | 18,8% | 0,23 | 23 | 9,75 | 0,41<18,75<37,86 |
| 100 mg | 13 | 81,3% | 4,33 | 433 | 9,75 | 62,14<81,25<100 |
| Total | 16 | |||||
| FDVD | No. pacientes | Porcentaje | Razón | Tasa | Error de muestreo | Intervalo de confianza al 95% |
| Normal | 7 | 43,7% | 1 | 100 | 12,4 | 19,3<43,7<68 |
| Disfunción | 9 | 56,3% | 1,29 | 129 | 12,4 | 32<56,3<80,6 |
| Total | 16 | |||||
| Probabilidad para HAP | No. pacientes | Porcentaje | Razón | Tasa | Error de muestreo | Intervalo de confianza al 95% |
| Baja | 7 | 43,7% | 2,3 1,16 | 230 116 | 12,4 | 19,4<43,7<68 |
| Intermedia | 3 | 18,8% | 0,42 0,5 | 42 50 | 9,76 | 0,32<18,8<37,9 |
| Alta | 6 | 37,5% | 0,85 2 | 85 200 | 12,1 | 13,8<37,5<61,2 |
| Total | 16 |
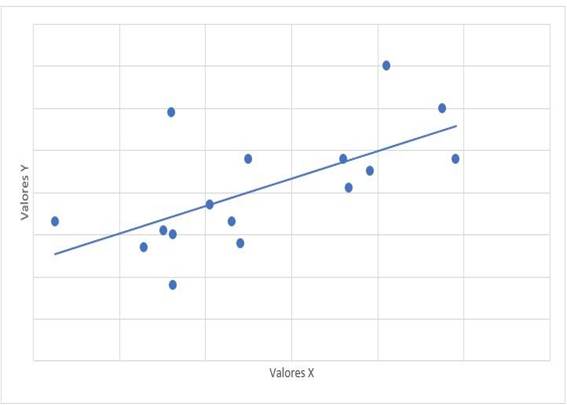
Gráfico 1: Diagrama de dispersión de correlación entre mPAP (x) y PSAP (y). mPAP: presión media de la arteria pulmonar. PSAP: presión sistólica de la arteria pulmonar. r=0,647, p=0,007
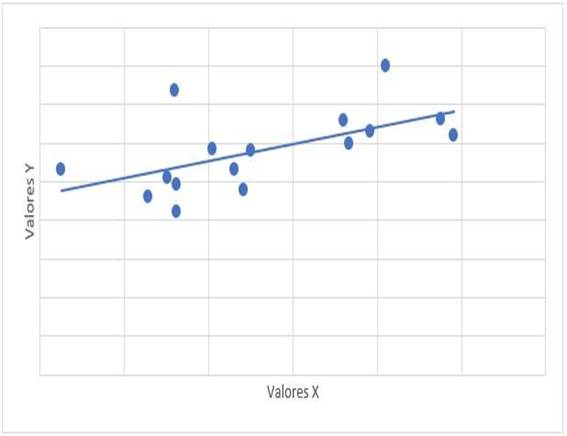
Gráfico 2: Diagrama de dispersión de correlación entre mPAP (x) y VmxRT (y). mPAP: presión media de la arteria pulmonar. VmxRT: velocidad máxima de regurgitación tricuspídea. r= 0,612, p=0,012
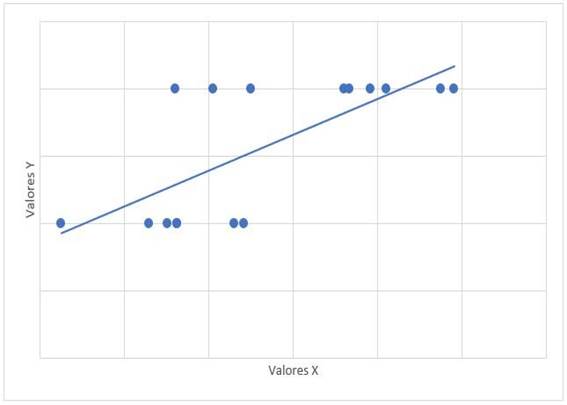
Gráfico 3: Diagrama de dispersión de correlación entre mPAP (x) y FDVD (y). mPAP: presión media de la arteria pulmonar. FDVD: ventrículo derecho. r= 0,708, p=0,002
DISCUSIÓN
La LMC es un desorden clonal hematopoyético que puede progresar a una fase acelerada y muerte. El uso de dasatinib ha mostrado una buena respuesta hematológica y citogénica, sin embargo se asocia a HAP, que es el resultado de proliferación anormal excesiva de músculo liso. El desarrollo de HAP condiciona afección de cavidades derechas cardiacas (disfunción diastólica), lo cual confiere un peor pronóstico. Las mediciones ecocardiográficas para evaluar la presencia de HAP son variadas, siendo la mPAP obtenida por tiempo de aceleración del TSVD una de las más confiables. Otros valores ecocardiográficos, cuando no se cuenta con mPAP o ésta no se considera confiable, sugieren probabilidad de HAP, clasificando la probabilidad en alta, intermedia o baja. Además, mediante uso de doppler, pulsado y tisular, es posible obtener la FDVD, la cual no es dependiente de la medida obtenida de mPAP.
Del total de pacientes estudiados con LMC tratados con dasatinib, nueve (56,2%) presentan cambios ecocardiográficos relacionados a HAP, de los cuales siete pacientes tienen mPAP estimada >25 mmHg y dos pacientes presentan probabilidad intermedia y alta para HAP (con mPAP <25 mmHg).
Como hallazgos adicionales, cinco pacientes se encontraron con derrame pericárdico leve y uno además presentó derrame pleural, cuatro presentaron mPAP mayor a 25 mmHg y el que presentó mPAP menor a 25 mmHg presentó probabilidad intermedia para HAP. Los cinco presentaron DDVD, una PSAP >35 mmHg y VmxRT>2,8 m/s. Dos pacientes de la muestra sin derrame pericárdico presentaron derrame pleural aislado. No se encontró registro previo del estudio de derrame pericárdico o pleural en pacientes con LMC tratados con dasatinib.
Otros hallazgos ecocardiográficos fueron la presencia de valvulopatías de grado leve: tres pacientes con sólo insuficiencia tricuspídea (IT); cuatro pacientes con sólo insuficiencia mitral (IM), de los cuales uno no presentó datos de HAP; dos pacientes con IM e IT leve, de los cuales uno no presentó datos HAP. Respecto a estas valvulopatías se usó el algoritmo para determinar las presiones de llenado del ventrículo izquierdo (VI) y disfunción diastólica, obteniendo de los pacientes con sólo IT e HAP dos pacientes con disfunción diastólica grado I con presión de la aurícula izquierda (AI) normal y un paciente indeterminado; de los pacientes con sólo IM, un paciente con disfunción diastólica grado II con incremento de presión en la AI y dos pacientes con disfunción diastólica grado I, con presión de la AI normal; el paciente con IM e IT juntas con HAP se clasificó como indeterminado.
No existen estudios previos de valvulopatías en los pacientes con LMC tratados con dasatinib. Estos resultados encontrados se consideran comorbilidades, dado que dos pacientes no se encontraron con HAP, solo en uno se determinó aumento de presiones de llenado que influyen en la presencia de HAP por la presencia de disfunción diastólica grado II y no por la presencia de IM leve, cuatro pacientes tuvieron presiones de llenado normales, y dos indeterminados. Al final del estudio se reportó la defunción de tres pacientes incluidos en la muestra. Un paciente falleció por progresión de la enfermedad a fase blástica, y dos pacientes por complicaciones asociadas a comorbilidades preexistentes (DM2 y ERC). Los tres pacientes cumplieron con mPAP ≥ 25 (HAP), presentaron DDVD, PSAP >35 mmHg, VmxRT >2,8 m/s, y probabilidad alta para HAP. No se encontraron estudios previos sobre la mortalidad por HAP en los pacientes con LMC tratados con dasatinib. Los resultados del estudio se deben a la presencia de comorbilidades que influyen en la progresión de HAP. Se halló la relación entre el tiempo de tratamiento con dasatinib con las cifras de mPAP de los pacientes estudiados utilizando la ecuación de Spearman; se obtuvo un valor de R= -0,315 (correlación negativa media), resultando una p no significativa.
En el estudio realizado por Minami et al.27, en el año 2017, se encontró relación negativa débil con una p no significativa. En el estudio realizado existe una relación entre la dosis y presencia de HAP, pero no se encontró significancia estadística, es decir el aumento de la dosis no necesariamente se acompaña de aumento en mPAP. En cuanto a la relación de mPAP con PSAP se obtuvo un valor de r= 0,647 (correlación positiva considerable) con un valor de p significativo (0,07), es decir el aumento de mPAP se acompaña con aumento de PSAP; no se encontraron estudios previos de la relación entre mPAP y PSAP. Se evaluó la relación entre mPAP con VmxRT encontrando un valor de r= 0,612 (correlación positiva considerable), se obtuvo un valor de p=0,012, siendo estadísticamente significativo, es decir el aumento de mPAP se acompaña del aumento del VmxRT; no se encontraron estudios previos donde se evalúe la relación entre mPAP con VmxRT. Se evaluó la relación entre mPAP y FDVD, obteniendo un valor de r= 0,708 (correlación positiva considerable), con valor de p significativo (0,02). No se encontraron antecedentes en estudios previos que hayan correlacionado mPAP con DDVD. En el estudio los resultados son debido a que existe DDVD en los pacientes con LMC y HAP estudiados. Se evaluó la relación entre la probabilidad para HAP con mPAP, obteniendo un valor de r=0,706 (correlación positiva considerable), el valor de p obtenido fue significativo (0,08); no se encontró estudio de esta relación en publicaciones previas. Este resultado del estudio se obtuvo porque existe una relación significativa entre la probabilidad de HAP y el valor de mPAP en los pacientes estudiados, donde a mayor valor de mPAP hay mayor probabilidad de HAP.
Con la evaluación de relación entre hallazgos ecocardiográficos se encontró una asociación significativa entre la estimación de mPAP (para definir HAP por ecocardiografía cuando mPAP≥25 mmHg) y los hallazgos ecocardiográficos relacionados a HAP (VmxRT, PSAP), que se obtienen de manera independiente a mPAP; además se evaluó la FDVD, parámetro que no suele evaluarse de forma rutinaria y que en este estudio se correlacionó de forma positiva con mPAP y la presencia de HAP. Además, se relacionó de una forma significativa la estimación de mPAP con la probabilidad de HAP obtenido por hallazgos ecocardiográficos. No se encontraron estudios previos donde se realice relación de las variables ecocardiográficas para HAP en pacientes con LMC tratados con dasatinib. Estos resultados del estudio son debido a que todos los hallazgos ecocardiográficos se relacionan de manera significativa con la presencia de HAP (determinada por mPAP), donde una estimación ecocardiográfica de mPAP menor a 25 mmHg no excluye la presencia de HAP, debiendo realizarse las otras evaluaciones ecocardiográficas.
El presente estudio, pretende ser un apoyo al Servicio de Cardiología y Hematología, de manera que los pacientes con LMC tratados con dasatinib lleven una monitorización estrecha con ecocardiograma previo al inicio de tratamiento y durante el mismo, evaluando todos los parámetros ecocardiográficos que mostraron utilidad, por una correlación positiva con HAP estimada por mPAP, específicamente cuando no se puede descartar HAP solo con un parámetro ecocardiográfico y no es factible realizar estudio invasivo por cateterismo derecho. Se pretende introducir la evaluación rutinaria de la FDVD en los pacientes tratados con ITK dado que este hallazgo aparece de forma temprana, y se traduce en progresión de la enfermedad. También, adentrarse en el campo de la cardioncología para realizar diagnósticos cardiovasculares tempranos (por ECOTT), y establecer tratamientos dirigidos a insuficiencia cardiaca e HAP en pacientes oncológicos que deben ser tratados con algún ITK.
El documentar HAP de manera temprana en pacientes con LMC en tratamiento con dasatinib es de importancia para realizar cambios en el tratamiento o tomar acciones para limitar el daño cardiopulmonar.
Las limitaciones de esta investigación fueron el tamaño de la muestra, que se vio afectada por ser un estudio retrospectivo; además por ser estudio correlacional los resultados encontrados no indican la existencia de una relación de causa y efecto entre las variables involucradas.
CONCLUSIÓN
La relación entre el tiempo de tratamiento con dasatinib con las cifras de mPAP tuvo una correlación negativa media. La relación de mPAP con la dosis de dasatinib tuvo una correlación positiva media. Cada una de las siguientes relaciones mPAP con PSAP, mPAP con VmxRT, mPAP con FDVD y probabilidad para HAP con mPAP tuvieron una correlación positiva considerable.
Los parámetros ecocardiográficos mPAP, VmxRT, PSAP, DDVD y la probabilidad ecocardiográfica para HAP son valores útiles y necesarios para valorar HAP. La determinación de todos estos parámetros debe realizarse de forma temprana y como seguimiento, ya que se encontró relación positiva considerable de cada uno con la presencia de HAP, la cual no es dependiente del tiempo de tratamiento ni de la dosis de dasatinib.











 text in
text in