Introducción
Los metales pesados son metales de masa atómica elevada por lo general del quinto o sexto período de la tabla periódica. Los metales son notables por su amplia gama de usos, su dispersión, su tendencia a acumularse en algunos tejidos del cuerpo humano y su potencial de ser tóxicos aun a niveles de exposición relativamente bajos (Hu, 2002).
Algunos metales como cobre y hierro son esenciales para la vida y juegan un papel importante en, por ejemplo, el funcionamiento de algunos sistemas enzimáticos. Otros metales son xenobióticos, o sea, no tienen ningún uso en los procesos fisiológicos y, como en el caso de plomo y mercurio, pueden ser tóxicos en cantidades imperceptibles. Aun los metales esenciales para el cuerpo humano, tienen el potencial de volverse dañinos si la persona es expuesta a altos niveles (Frazar, 2000).
El “U. S. Agency for Toxic Substances and Disease Registry” (ATSDR) enumera todos los peligros y daños presentes en desechos tóxicos de acuerdo a la severidad de su toxicidad. Según esta lista, en primer, segundo, tercer y sexto lugar se encuentran los siguientes metales pesados: plomo, mercurio, arsénico y cadmio, respectivamente (García & Dorronsoro, 2004).
La exposición a metales puede ocurrir a través de diversas maneras. Pueden ser inhalados como polvo o humo (por ejemplo, partículas de óxido de plomo en la combustión de gasolina con plomo); otros pueden ser evaporados y por consiguiente inhalados (mercurio en la producción de lámparas fluorescentes). Los metales también pueden ser ingeridos involuntariamente a través de comida o bebida. La cantidad que puede ser absorbida por el tracto digestivo depende de la forma o configuración química, la edad y el estado de nutrición de la persona. La excreción ocurre por medio de los riñones y el tracto digestivo, pero los metales tienden a persistir en sitios de almacenaje como el hígado, huesos y riñones y pueden permanecer ahí durante años o décadas.
Por ejemplo, el plomo en el suelo tiende a concentrarse en vegetales con raíz como la cebolla y es absorbido en mayor cantidad en individuos cuyas dietas son deficientes en calcio, hierro o zinc. La exposición a plomo puede desarrollar problemas de salud como convulsiones, coma, fallo renal y hasta la muerte dependiendo de la dosis. Los niños y los fetos aparecen particularmente vulnerables a efectos neurotóxicos por causa del plomo. Estudios han demostrado que mujeres embarazadas que tienen plomo almacenado en sus huesos muestran un movimiento acelerado de éste al torrente sanguíneo y a la leche materna lo cual está asociado a nacimientos de bebés con bajo peso y decrecimiento en la razón de crecimiento y del desarrollo mental (Campos, 1987).
Cuando el contenido de metales pesados en el suelo alcanza niveles que rebasan los límites máximos permitidos causan efectos inmediatos como inhibición del crecimiento normal y el desarrollo de las plantas, y un disturbio funcional en otros componentes del ambiente, así como, la disminución de las poblaciones microbianas del suelo, el término que se usa o se emplea es “polución de suelos” (Martín, 2000).
Los metales pesados como el cobre, plomo, arsénico y cadmio pueden alcanzar niveles de concentración que provocan efectos negativos en las propiedades físicas, químicas y biológicas del suelo como: reducción del contenido de materia orgánica, disminución de nutrimentos, variación del pH generando suelos ácidos, amplias fluctuaciones en la temperatura, efectos adversos en el número, diversidad y actividad en los microorganismos de la rizósfera, dificultan el crecimiento de una cubierta vegetal protectora favoreciendo la aridez, erosión del suelo, y la dispersión de los contaminantes hacia zonas y acuíferos adyacentes y como consecuencia aumenta la vulnerabilidad de la planta al ataque por insectos, plagas y enfermedades, afectando su desarrollo (Martin et al.,1996; Zhang et al., 2000; Vega & Mejía, 2017).
Para elucidar el comportamiento de los metales pesados en los suelos y prevenir riesgos tóxicos potenciales se requiere la evaluación de la disponibilidad y movilidad de los mismos. La toxicidad de los metales depende no sólo de su concentración, sino también de su movilidad y reactividad con otros componentes del ecosistema.
Actualmente existen estudios tendientes a resolver la contaminación originada por metales pesados en suelos, mediante estrategias basadas en el uso de plantas que tienen la propiedad de acumular metales pesados; proceso denominado “fitorremediación” que consiste en la remoción, transferencia, estabilización y/o degradación y neutralización de compuestos orgánicos, inorgánicos y radioactivos que resultan tóxicos en suelos y agua.
Esta novedosa tecnología tiene como objetivo degradar y/o asimilar, los metales pesados, presentes en el suelo, lo cual tiene muchas ventajas con respecto a los métodos convencionales de tratamientos de lugares contaminados; en primer lugar es una tecnología económica, de bajo costo, en segundo lugar posee un impacto regenerativo en lugares en donde se aplica y en tercer lugar su capacidad extractiva se mantiene debido al crecimiento vegetal.
La fitorremediación no es un remedio para todos los suelos contaminados, antes de que esta tecnología pueda volverse técnicamente eficiente y económicamente viable, hay algunas limitaciones que necesitan ser superadas como por ejemplo, sus mecanismos tanto moleculares, bioquímicos y fisiológicos los cuales son pocos conocidos e insuficientemente entendidos, sin embargo, a pesar de esto un gran número de plantas hiperacumuladoras todavía pueden descubrirse e identificarse (Prasad & Freitas, 2003).
No encontrándose investigaciones en nuestro país utilizando el girasol Helianthus annus L. (Asteraceae) como organismo fitorremediador de metales pesados presentes en relaves mineros, y estando la mayor parte de los suelos agrícolas principalmente de la parte media del cuenca del río Moche contaminados por metales pesados, debido a más de 70 años de riego con aguas del río Moche contaminados por la explotación minera en la zona de Shorey y Quiruvilca; por lo que es de particular interés la realización de estudios de detoxificación de suelos utilizando a esta especie, lo que nos permitiría utilizarlo en el futuro como organismo biorremediador. Los objetivos planteados en la presente investigación son: Cuantificar la concentración de los metales pesados cobre, plomo, cobalto y absorbidos por la raíz, tallo y hojas del girasol Helianthus annus a partir de suelos agrícolas contaminados por 25, 50 , 75 y 100% de relaves mineros del área de Samne, a los 30, 60 y 90 días de crecimiento vegetativo; así como determinar la parte del girasol Helianthus annus en donde se da la mayor absorción de los metales pesados cobre, plomo, cobalto y cadmio.
Material y métodos
El material de estudio estuvo constituido por muestras de suelos agrícolas contaminados por el: 25, 50, 75 y 100% de relaves mineros del área de Samne, y por plántulas de “girasol” Helianthus annus L. (Asteraceae) generadas a partir de semillas obtenidas de proveedores agrícolas.
La muestra de suelo fue colectada del campo experimental de Ecología de la Universidad Nacional de Trujillo. En el lugar se determinaron los parámetros físicos de temperatura, humedad relativa y pH utilizando un medidor multiparámetro. Para colectar la muestra de suelos se utilizaron palanas jardineras y bolsas plásticas dobles estériles. En el laboratorio se removieron todo tipo de material extraño, luego el remanente se tamizó con un tamíz de 2 mm de diámetro y guardado en ambiente ventilado del Laboratorio de Ecología de la Universidad nacional de Trujillo.
Se utilizó como prueba control una muestra de suelo agrícola sin relave a la cual solo se le añadió tres semillas de “girasol” Helianthus annus, y fueron procesadas de la misma forma que las muestras experimentales. Se prepararon cuatro grupos experimentales: 25, 50, 75 y 100% de suelos con relave por triplicado para determinar el grado de asimilación de los metales pesados Cu, Pb, As, y Cd, a nivel de raíz, tallo y hojas, a los cuales se les agregó la semilla de “girasol” Helianthus annus. Luego de realizar la colecta de relave de la zona de Samne, a continuación se determinó la concentración cobre (Cu), plomo (Pb), arsénico (As) y cadmio (Cd) presente en la muestra. Se determinaron las concentraciones iniciales y finales de los metales Cu, Pb, As y Cd presentes en el suelo, así como en las raíces, tallo y hojas, a los 30, 60 y 90 días de iniciado el experimento. Para la extracción de los metales de la muestra de suelo y del tejido de raíz, tallo y hojas del girasol se siguió el protocolo propuesto por Aquino et al., 1989, y cuya marcha analítica consiste primero en pesar 3 g de muestra con relave y suelo o de tejido de girasol, y luego se coloca en el horno mufla durante 4 a 8 hrs. a 500 ºC.
Inmediatamente luego de ser enfriados, se comenzó con la digestión de la muestra. A cada crisol que contiene la muestra calcinada se le agregó 3 ml de HCL concentrado, se lavó y a continuación se transfirió la muestra a un vaso de precipitación de 50 ml. Luego se añadió al crisol 1 ml de HN03 concentrado realizándose un nuevo lavado. Finalmente se agregó 3 ml de HCL al 10% y se transfirió a un vaso de precipitación de 250 ml. A continuación se filtró el material en una fiola de 100 ml el contenido del vaso de precipitación utilizando papel whatman # 40.
Durante el proceso de filtración, se lavó el residuo con HCL al 10% hasta que quede incoloro. El papel filtro también se enjuagó varias veces con HCL al 10% hasta remover completamente todo el residuo. Terminada la filtración aforar a 100 ml con HCL al 10%. Por último, el filtrado se transferirá a botellas plásticas debidamente rotuladas y con tapa rosca para ser almacenadas hasta el momento de la lectura con el espectrofotómetro.
Resultados
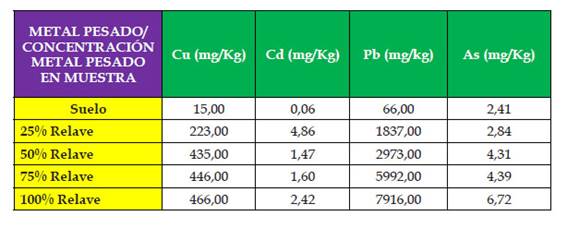
Los valores de los parámetros ambientales tomados en cuenta durante la recolección de la muestra de material de relave y muestra de suelo como temperatura, humedad relativa y pH para el fueron los siguientes: Para el material de relave, la temperatura fue de 24,2 ºC, la humedad relativa fue de 65,0% y el pH 5,2. Por su parte, en la muestra de suelo se determinó una temperatura de 24,6 ºC, humedad relativa de 70,0% y un pH 6,9.
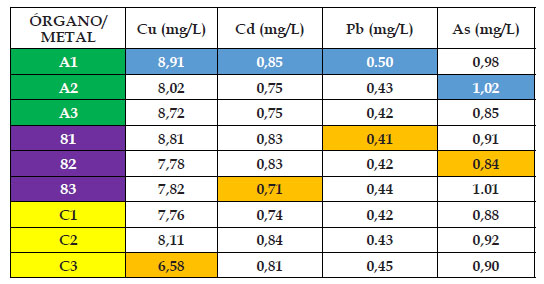
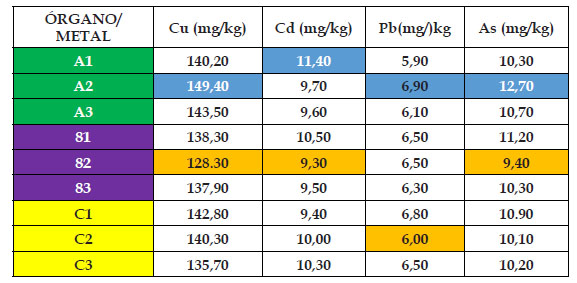
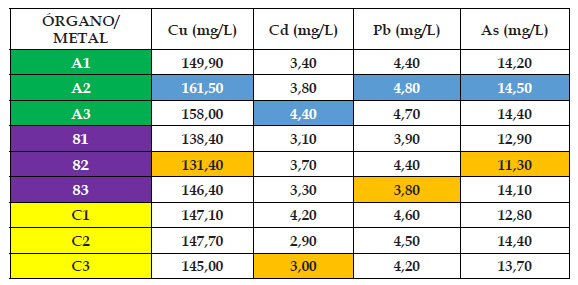
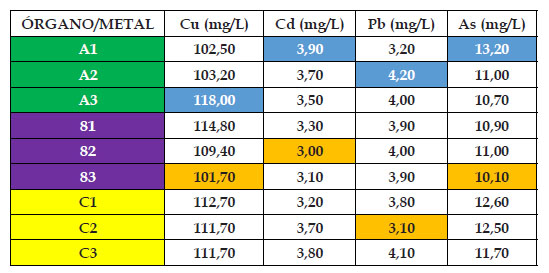
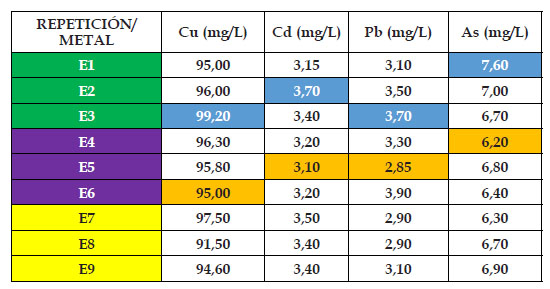
En los Cuadros 2,3,4,5 y 6 se pueden observar los resultados de la presente investigación, en donde el “girasol” Helianthus annus mostró diferentes resultados para cada órgano, metal y concentración durante los 120 dias de experiencia. Para el material de relave cobre, el contenido mínimo de absorción en el grupo control fue de 6,58 mg/kg en hoja, mientras que el máximo fue de 8,91 mg/ kg en raíz; mientras que para los casos de 25%, 50%, 75% y 100% de material de relave cobre fue de 128, 30; 131,40; 101,70 y 95,00 mg/kg en el órgano tallo. En cambio los mayores valores del material cobre fueron de: 149,40; 161,50; 118,00 y 99,20 mg/kg, en este caso en el órgano raíz; observándose como inicio del punto saturación en el nivel de absorción la concentración de 75% de material de relave cobre, además que el órgano raíz fue el mayor acumulador de este metal.
Para el material de relave cadmio, el contenido mínimo de absorción en el grupo control fue de 0,71 mg/kg en tallo, mientras que el máximo fue de 0,85 mg/kg en raíz; mientras que para los casos de 25%, 50%, 75% y 100% de material de relave cadmio fue de 9,30; 3,00; 3,00 y 3,10 mg/kg en el órgano tallo, salvo el caso de que en la concentración de 50% esta se llevó acabo en la hoja. En cambio, los mayores valores del material cadmio fueron de: 11,40; 4,40; 3,90 y 3,70 mg/kg, en este caso en el órgano raíz; observándose como inicio del punto de saturación en el aumento en el nivel de absorción a partir del 50% del material de relave cadmio en adelante, además que el órgano raíz fue el mayor acumulador de este metal.
En el caso del material de relave plomo, el contenido mínimo de absorción en el grupo control fue de 0,41 mg/kg en tallo, mientras que el máximo fue de 0,50 mg/ kg en raíz; mientras que para los casos de 25%, 50%, 75% y 100% de material de relave cadmio fue de 6,00; 3,80; 3,10 y 2,85 mg/kg en el órgano hoja y tallo. Con respecto a los mayores valores del material plomo fueron de: 6,90; 4,80; 4,20 y 3,70 mg/kg, en este caso todos en el órgano raíz; observándose como punto de saturación en el aumento en el nivel de absorción a partir del 50% del material de relave plomo en adelante, además que el órgano raíz fue el mayor acumulador de este metal.
Finalmente, para el material de relave arsénico, el contenido mínimo de absorción en el grupo control fue de 0,84 mg/kg en tallo, mientras que el máximo fue de 1,02 mg/kg en raíz; mientras que para los casos de 25%, 50%, 75% y 100% de material de relave arsénico fue de 9,40; 11,30; 10,10 y 6,20 mg/kg en el órgano tallo. En cambio los mayores valores del material arsénico fueron de: 12,70; 14,50; 13,20 y 7,60 mg/kg, en este caso en el órgano raíz; observándose como punto quiebre en el aumento en el nivel de absorción a partir del 75% del material de relave arsénico en adelante, además que el órgano raíz fue el mayor acumulador de este metal.
Discusión
Las características favorables del girasol como planta fitorremediadora son: facilidad de manejo en su cultivo; se adapta fácilmente a un amplio intervalo en la variación de temperatura; la época de la siembra es variable y depende de las características climatológicas de cada región; es una planta hiperacumuladora de una variedad de metales pesados como: Cr (III), Cr (IV), (Davies et al., 2001; Prieto et al., 2009), de As, Bi, Cd, Cu, Mn, Pb, Sb, TI y Zn (Cabrera et al., 1999; Christie et al., 2004), también de metales radioactivos como uranio (De Oliveira et al., 199); es una planta micotrófica (Davies et al., 2001) y puede remediar tanto suelos como aguas contaminadas.
Actualmente, existen estudios tendientes a resolver la contaminación originada por metales pesados en suelos, mediante estrategias basadas en el uso de plantas que tienen la propiedad de extraer y acumular metales pesados; proceso denominado “fitorremediación”. Es decir, la “fitorremediacion”, es una técnica que consiste en aprovechar la habilidad de las plantas que están cultivadas en un suelo contaminado y pueden ser cosechadas, incineradas o compostadas (Boye, 2002; Aminayan et al., 2018).
Los metales pesados son elementos químicos, presentes en todo tipo de suelo y sus niveles de abundancia se reporta en porcentajes y partes por millón. Cuando el nivel de su contenido en el suelo es por abajo de los límites permitidos presenta un efecto inocuo en la vegetación y en las poblaciones microbianas. Cuando el suelo presenta niveles mayores a los límites permitidos de estos elementos, se provoca la contaminación de suelos, en este caso se afecta a largo plazo a las plantas y a los microorganismos. Cuando el contenido de metales pesados en el suelo alcanzan niveles que rebasan los máximos permitidos se generan efectos inmediatos como inhibición del crecimiento normal y el desarrollo de las plantas, lo que a su vez causa un disturbio funcional en otros componentes del ambiente, así como la disminución de las poblaciones microbianas del suelo, entre otros (Kabata, 1995).
De acuerdo a Kloke, 1980 los valores normales de los metales pesados Cu, Cd, Pb y AS en suelos a nivel del Cu es de 1,0 a 20 mg/kg; Cd de 0,1 a 1,0; Pb de 0,1 a 20 y As de < 5,00 a 40,0. En la presente investigación los valores fueron de Cu 15,0; Cd 0,06; Pb 66,0 y As 2,41mg/kg, valores coincidentes salvo el caso del Pb cuyo valor es el triple pero que sin embargo coincide con el valor propuesto por Bowie & Thornton, 1985 de 10 a 20 mg/kg.
Kumar et al., 1995; Cabrera et al., 1999; Reeves, 2003 y Christie et al., 2004; Van Oer Ent, 2013; sostienen que el girasol Helianthus annuus es la especie que absorbe los metales pesados en mayor cantidad en sus raíces que en sus brotes si se cosecha la biomasa entera de la planta, por lo que se considera una planta hiperacumuladora favorable en la fitoextracción de Cd, Cu , As , Zn, Pb y elementos radiactivos, hecho comprobado en la experiencia y en donde a nivel del
metal cobre presente en el relave y en una concentración del 50% el valor fue de 161,50 mg/kg..
En los Cuadros del 2 al 6 se observa que en el caso del cobre el punto de saturación se inicia a nivel del 75% de concentración del metal; mientras que el caso del cadmio y plomo este se da a nivel del 50%, mientras que en el arsénico la saturación se da a nivel del 75% de que a los 90 dias de crecimiento. El punto de quiebre en la absorción de los metales pesados Cu, Cd, Pb y As, se menciona que ocurre a través del bloqueo de las actividades biológicas, es decir, la inactivación enzimática por la formación de enlaces entre el metal y los grupos - SH (sulfhidrilos) de las proteínas, causando daños irreversibles en los órganos de los diferentes organismos como las plantas.
Sobre el particular, Bonilla (2013), trabajando con el “amaranto” Amaranthus hybridus, “acelga” Beta vulgaris y “alfalfa” Medicago sativa como fitorremediadores de plomo, encuentra que el amaranto se satura en su absorción de plomo a los 90 días, la acelga a los 30 días, mientras que la alfalfa lo hace a los 45 días, guardando una relación con la presente investigación con el amaranto ya que al igual que el caso mencionado el girasol también se satura a los 90 días.
Además, Gough & Erdman (1979), afirman, que entre las respuestas fisiológicas de las plantas frente a los efectos de los contaminantes como los metales pesados estos están también relacionadas con cambios en los procesos respiratorios, disminución de la concentración de ATP, alteraciones en la fijación del nitrógeno, acumulación de los elementos tóxicos y perjuicio en la reproducción; en razón de que parte de estos procesos ocasionan lentamente cambios ultraestructurales y modificaciones observables al microscopio de luz, como el porcentaje de muerte o de plasmólisis celular.
De igual modo, asociando lo afirmado por Gough y Erdman con la presente investigación y observado los cuadros de absorción de los metales Cu, Cd, Pb y As, se observa que los puntos de saturación son bien marcados, esto probablemente debido al efecto drástico de la absorción de los metales pesados; estas concentraciones como lo sostiene Prasad (2004) tienen un efecto posterior sobre la absorción de los metales por los órganos de las plantas.
Según, McCune & Goward, 1995 el que no exista un alto grado de absorción de los metales pesados, especialmente de Cadmio, Plomo y Arsénico, a partir de las concentraciones de estos metales presentes en el material de relave y de suelos, estaría relacionado con el hecho que en el caso de los especies vegetales, estos a nivel celular sufren la plasmólisis de sus células y por lo tanto tienden a disminuir la absorción de los estos metales.
Sin embargo, sobre el particular también hay que mencionar que para que estos metales pesados puedan ejercer su toxicidad como lo manifestado, éstos deben encontrarse disponibles para ser captados por el órgano en éste caso la raíz, es decir que el metal debe estar biodisponible. Por otra parte, el concepto de biodisponibilidad se encuentra íntimamente relacionado con las condiciones fisicoquímicas del ambiente, que determinan la especiación del metal y por lo tanto la concentración de metal libre y lábil. Por ello es fundamental que al determinar el grado de contaminación por metales pesados de un ambiente, y su efecto sobre los seres vivos es necesario conocer su biodisponibilidad, es decir, la concentración de metal libre presente en la muestra.
Freitas et al., 2004; Prasad & Freitas, 2003; Raskin et al., 1994, sobre el particular consideran que hay muchas limitantes que necesitan ser superadas en las investigaciones, porque por ejemplo, los mecanismos moleculares, bioquímicos y fisiológicos son poco conocidos e insuficientemente entendidos, al igual que los procesos que desarrollan las plantas conocidas como hiperacumuladoras que es el caso del “girasol”.
Asimismo, Clemens et al., 2002; Maagher, 2002; Lovley & Coates, 1997, sostienen que no hay planta con todas las características adecuadas con los criterios ideales de una planta hiperacumladora eficaz para todos los metales pesados, en este caso se ha comprobado para el metal cobre con su alto nivel de absorción realizada por el girasol, pero en menor proporción para cadmio, plomo y arsénico; por lo que es necesario y viable que a futuro puedan ser modificarlas genéticamente para mejorarlas y emplearlas satisfactoriamente como agentes en el proceso de fitorremediación.
En el caso del metal plomo, Buendía et al., 2014, al realizar una investigación de fitorremediación del girasol y la concentración de plomo absorbido encuentra un rango de 21,03 a 26,09 mg/kg, valores cercanos al reportado en la presente investigación cuyo valor es de 16,90 mg/ kg con la diferencia que en su investigación utilizaron sustancias coadyuvantes para una mayor absorción de plomo como es el caso humus de lombriz, aserrín de bolaina blanca y perlita blanca.
Por otra parte, Baker & Brooks, 1989; Chaney et al., 1997; Chaney et al., 2000; Chen et al., 2001; Villalobos & Ferreres, 2016, realizan una discriminación al sostener que todas las plantas poseen un potencial para absorber una amplia variedad de metales del suelo, pero la mayor parte de las plantas tienden solamente a absorber los que son esenciales para su supervivencia y desarrollo. Sin embargo sostienen también que existe una notable excepción de esta regla para un pequeño grupo de plantas que pueden tolerar, absorber y translocar diferentes niveles de ciertos metales pesados como el cobre, cadmio, plomo y arsenico, relación que hemos comprobado en la presente investigación.
Comparativamente, Martín et al., 1996, trabajando con la planta Pteris vittata comprobó que ésta es capaz de absorber el peligroso arsénico, pero lo más determinante es que el helecho crece mejor en suelos que contienen elevadas concentraciones de arsénico que en los que carecen de él.
Con respecto al Cadmio, Brooks 1998; Davies et al., 2001; manifiestan que el cad- mio como se ha comprobado en la pre- sente investigación se puede acumular en el girasol, Helianthus annuus, más aún han determinado que el girasol es una especie rizofiltradora potencial de níquel, cobre, arsénico, zinc, cromo y plomo; así como de radioisótopos; similares características en- contraron Ruiz et al., 2013, trabajando con la higuerilla Ricinus comunnis L.
Desde el punto de vista ecológico el papel de las plantas hiperacumuladoras como es el caso del girasol no está aun completamente claro, pero se ha supuesto que éstas suministran protección contra el ataque de hongos patógenos e insectos. Las recientes evidencias han confirmado la función de protección de la acumulación de níquel contra hongos y bacterias patógenos en Steptanthus polygaloides e insectos herbívoros en S. polygaloides y T. montanum (Li et al., 2003). El efecto contra los insectos herbívoros está bien demostrado en Thlaspi caerulescens, que es una planta hiperacumuladora de zinc.
Finalmente, coincidiendo con la información de Huang et al., 1997 el suceso natural de especies de plantas capaces de acumular extraordinariamente altos niveles de concentraciones de metales pesados hace de la investigación un proceso particularmente interesante. Como resultado, se están obteniendo los primeros avances para la comprensión de los mecanismos a nivel molecular por los cuales las plantas son capaces de tolerar los excesos y absorber metales pesados, que serían venenos peligrosos para otras especies, mientras que las hiperacumuladoras los incorporan como nutrientes.
Unavancede ello, como lo ha demostrado Hall (2002), es la identificación de genes responsables de la hiperacumulación de los metales en los tejidos finos de la planta, los que ya se han reproducido en el laboratorio. Así, el metabolismo del glutatión y de los ácidos orgánicos desempeñan un papel importante en plantas que toleran metales. En el proceso de fitorremediación de metales en el ambiente, los ácidos orgánicos desempeñan un papel importante en la tolerancia del metal.
En forma preliminar se ha podido encontrar una correlación entre la cantidad de cobre, cadmio, plomo, y cadmio arsénico acumulado por el girasol, respecto al que se encuentra en el material de relave y muestra de suelo; encontrándose estos por encima de los valores máximos permisibles (Cu = 4, Cd=0,05; Pb = 5 y As= < 5 mg/kg). Sin embargo, por ser una especie silvestre y encontrarse casi en todos los ambientes terrestres de acuerdo con sus condiciones microclimáticas, puede ser utilizada como bioconcentradora y biorremediadora.
Conclusiones
El “girasol” Helianthus annus (Asteraceae) es un buen fitorremediador de cobre, porque extrajo altos niveles de este metal pesado del suelo contaminado por relaves mineros a nivel de raíz, tallo y hojas en todos los tratamientos del experimento, que variaron entre 95,00 hasta 161,50 mg/ kg, en comparación con los metales cadmio, plomo y arsénico.
El valor de saturación de absorción del metal cobre se dio en la concentración de 75%, mientras que para el cadmio y plomo en el nivel de 50%, y para el arsénico en 75% respectivamente.












 uBio
uBio