INTRODUCCIÓN
A nivel mundial las tres algas marinas de mayor producción acuícola para el consumo humano directo son: Laminaria japónica (kombu), Undaria pinnatifida (wakame) y Porphyra sp. (nori); siendo el género Porphyra el que presenta la mayor producción en la maricultura japonesa y un mayor valor económico a comparación del kombu y el wakame (McHugh, 2002; FAO, 2016). Además, se caracteriza por su gran riqueza en proteínas, mucilagos, oligoelementos y vitaminas, por lo que existe un elevado aprovechamiento de las algas en la alimentación humana (Aragón et al., 2012). Específicamente, sus propiedades se han atribuido a distintos compuestos bioactivos: polisacáridos sulfatados, polifenoles, carotenoides, aminoácidos, proteínas/péptidos y lípidos (Mohamed et al., 2012).
El talo de Porphyra sp. es de color verde olivo, marrón rojizo o marrón. Los individuos monoicos o dioicos presentan el soro reproductivo marginal o disperso, a veces confinado a distintos sectores del folio. El soro masculino está formado por paquetes de espermatangios y el femenino por gametos a menudo con tricomas conspicuos. Cada gameto femenino después de la fertilización forma paquetes de 8 a 16 cigotosporangios (Sutherland et al., 2011; Guiry & Guiry, 2018).
En el Perú, las algas marinas son exportadas y utilizadas como materia prima en la industria de alginatos, carragenanos y agar; también se utilizan para consumo humano directo y para la elaboración de productos de aseo personal (Vivanco et al., 2011; Aragón et al., 2012). Además, otro uso que se le da es en forma de polvo seco como aditivo para la alimentación animal o como fertilizantes agrícolas (FAO, 2016).
En base a lo antes expuesto, se desarrolló el crecimiento de las macroalgas Porphyra sp. en su etapa conchocelis y para llevarlas en un futuro a la maricultura; evaluando el efecto con diferentes nutrientes (fertilizantes) en la etapa microscópica llamada conchocelis.
Se tuvo como objetivo determinar el efecto de los nutrientes comerciales óptimos como fuente de nitrógeno y fósforo (Nitrato y Fosfato de Bayfolan® y de solución hidropónica La Molina.
MATERIAL Y MÉTODOS
Lugar de ejecución
Las muestras se recolectaron en la playa Santa Elena ubicada en la Bahía de Paracas (13°49′36″S; 76°16′22″O) en la provincia de Pisco, región Ica, Perú. Para después transportarlas al Laboratorio de Biofactoria ubicado en el Centro Modelo de Tratamientos Residuos (CEMTRAR) de la Universidad Nacional Agraria La Molina (UNALM), Lima, Perú, en contenedores térmicos aislados en frío (tipo cooler) para evitar el estrés térmico o radiación solar en el transporte.
Recolección de las muestras
Se colectó frondas fértiles de Pyropia sp. con coloración rojiza en los márgenes del talo en la playa Santa Elena ubicada en la Bahía de Paracas.
Medición del área Convexa del Bivalvo
Las conchas enteras fueron lavadas con detergente, luego, se determinó el área convexa de la superficie de la valva con el software FIJI-ImageJ que, mediante fotografías tomadas a todas las valvas a una altura de 20 cm, se pudo determinar el área de cada una de ellas para saber la cobertura de crecimiento.
Esterilización del agua de mar
Para lograr el proceso de esterilización del agua de mar se llevaron a cabo cuatro etapas.
Primera etapa
Se subdividió en dos momentos: el proceso de filtración y la esterilización mediante rayos ultravioleta (UV). La filtración se llevó a cabo con un sistema RAS mediante 3 cartuchos de filtro hilado (1,5 y 10 micras, MY-RO50E) de polipro- pilenos por 24 horas para retener los sólidos que provienen del mar y así evitar su interferencia con el láser del fotocolorímetro (YPT 9500). Seguida- mente, se procedió a la esterilización mediante UV a través de una lámpara que expuso el agua a la radiación UV para destruir cualquier microorganismo remanente.
Segunda etapa
Cloración, donde el agua se sometió a una segunda esterilización, esta vez por cloro. Se agregaron 2 mL de cloro líquido por L de agua de mar, para ser aireada por al menos 24 h, al terminar este proceso se procedió a titular el agua con una solución 2 mL de tiosulfato para liberar el agua del cloro, se agregaron 2 mL de solución de tiosulfato 0,498 M por litro de agua clorada. Para preparar la solución de tiosulfato se agregaron 10 g de tiosulfato de sodio en 100 mL de agua destilada para luego de agregar la solución de tiosulfato al agua clorada, se corroboró que no haya cloro disuelto en el agua de mar con un kit de cloro para evaluar la presencia o ausencia de cloro.
Tercera etapa
Se procedió a esterilizar en autoclave, una vez corroborada la ausencia de cloro, el agua fue vertida en vasos precipitado de 500 ml con su respectiva concha de abanico (A. purpuratus), al fondo de cada vaso precipitado con posición convexa hacia arriba y cubrió la totalidad de la base para tener mayor área de asentamiento disponible por las cigotosporas. Una vez colocada el agua y la valva se sometieron a la autoclave por 25 min a 121°C. Al culminar el tiempo se dejó enfriar por 2 h para agregar los nutrientes comerciales Bayfolan® con diferentes proporciones 25%, 50% y 100% y solución hidropónica La Molina, soluciones concentradas A y B a diferentes proporciones ya mencionadas. Cada vaso precipitado fue rotulado con las diferentes proporciones y nombre de los tratamientos y fueron colocados dentro de la cámara de germinación (TE-4020 Tecnal) para que vayan teniendo una temperatura de trabajo de 15°C.
En la cuarta etapa
Se utilizó una cámara de germinación (TE-4020 Tecnal) para conchocelis que permitió estudiar los efectos de los factores ambientales sobre estos procesos fisiológicos del cultivo Porphyra (en su etapa conchocelis), la temperatura óptima por cada proceso esporofita, intensidad de luz (fotoperiodo, horas de luz). En este estudio, debido a que la razón principal para estos experimentos estaba relacio- nada con el cultivo artificial, también se examinaron parámetros como: Nitratos (NO3), Fosfato (PO4) con el Standard Method2 4500-NO3-D- 2000y pH (USGS Method I-1586-85).
Liberación de cigostopora
Lo primero que se hizo en esta etapa fue transferir los talos reproductivos, se cortaron y se retiraron luego de ser sometidos a estrés por una hora. Se usaron guantes de nitrilo para la manipulación; cuidadosamente se retiró el papel aluminio y se cogieron las estructuras reproductivas con pinza estéril para transferirlos dentro de matraces estériles, todo esto fue realizado dentro de una cámara de flujo laminar; seguidamente, se llenaron con agua de mar enriquecida con los fertilizantes comerciales y tapados con Parafilm.
De manera posterior se diseñó un sistema de aireación con tuberías de 0,5 cm de diámetros, con llave de paso de aire, filtros de 0,22 micrómetros y un flujo promedio de 7,2 ± 0,8 L*s-1 para cada matraz (5 en total) más 1 g de peso Pyropia sp. inmediatamente se cubrieron con papel aluminio y se dejaron airear por 24 horas para que pudieran liberar las cigotospora. Por último, en esta etapa, se procedió al conteo de cigotospora, utilizando matraces de cultivo para determinar la densidad de esporas por cada matraz.
Inoculación de Cigotosporas y Asentamiento
Se utilizó el caldo de cigotosporas con el mayor número de células 1,25x108*L-1, se usó 40 ml de la solución madre para cada unidad experimental, vertiendo con una pipeta esterilizada de 10 ml; además se agregó 2 ml de dióxido de germanio (GeO2) por litro, ya que el factor de contaminación es el desarrollo de diatomeas, luego se selló el vaso de precipitado con Parafilm para evitar cualquier fuente de contaminación del medio externo. Las valvas que estaban ya con las cigotosporas estaban en asentamiento y fueron mantenidas sin aireación por dos semanas con un fotoperiodo neutro (12 horas luz y 12 horas oscuridad) a 15 °C. Posterior- mente, se retiró la valva para evaluar el número de cigotosporas asentadas y luego se cambió el medio de cultivo semanalmente para evaluar los parámetros de nitrato, fosfato y otros.
Se contó el número de esporas asentadas 72 horas después de la siembra en el estereoscopio (AS ONE, SZM-T-LED). De esta manera, se determinó el porcentaje de asentamiento (# de esporas asentadas / # de esporas sembradas) y se determinó la densidad de asentamiento (# de esporas asentadas y germinadas/valva). Después de 48 horas, después de la siembra se contó el número de esporas germinadas donde se determinó la densidad de germinación (número de esporas germinadas/valva) y porcentaje de germinación (número de esporas germinadas / número de esporas asentadas).
Diseño experimental
En la etapa de asentamiento y crecimiento del conchocelis se aplicó un diseño completo al azar (DCA) con tratamientos al 0, 25, 50 y 100 por ciento, tres unidades experimentales de conchas de abanico y 3 repeticiones. Se usó un α = 0,05 donde previamente se examinaron las suposiciones de ANOVA (homogeneidad de varianzas y distribución normal). Para determinar el crecimiento de conchocelis entre los tratamientos de nutrientes se realizó comparaciones donde se utilizó la prueba Tukey.
RESULTADOS Y DISCUSIÓN
Áreas superficiales de las conchas de abanico La concha del bivalvo presenta manchas que evidencian el crecimiento de conchocelis; por ello, se hizo un monitoreo en paralelo del crecimiento de estas en portaobjetos (Ruangchuay & Notoya, 2003); debido a que no es posible observar el crecimiento de dentro del bivalvo.
Por otro lado, se tomó fotografías de la superficie convexa de todos los bivalvos para determinar el área superficial mm2 de conchocelis como se visualiza en la Tabla 1; obteniéndose el porcentaje de cobertura (Gonzalez, 2018). Los bivalvos no presentaron la misma área superficial (*) ya que varían de 4225,8 a 6694,3 mm2; estos presentan diferencias en la desviación estándar no mayor del 5 por ciento, cuya razón es el tamaño de los bivalvos, ancho, largo e inclusive alto, ya que la altura le da una curvatura inclinada, generando en ellas una mayor área superficial y también se obtuvo la cobertura (**) de conchocelis en la superficie convexa del bivalvo.
Determinación de la calidad de agua de mar
Se observó en los ensayos que el agua de mar proveniente de Paracas-Pisco, presentaba alta carga de material particulado, dificultando el análisis de diferentes parámetros. Por tal motivo, se diseñó un sistema RAS con UV integrado para disminuir la carga microbiana; además, se añadió cloro con una dosis de 2 ml por litro de agua de mar y adicionalmente de esterilizó, utilizando una autoclave a 121 °C por 25 minutos (Hafting, 1998).
Parámetros físicos para el Crecimiento de conchocelis
Para lograr los parámetros físicos del desarrollo inicial de la fase conchocelis de P. columbina se incubó a 12 °C - 15 °C, 40 - 60 μmol m-2 s-1 con fotoperíodo 12:12 (horas luz: oscuridad) (Romo, 1995). Con ello, se obtuvieron los siguientes resultados (Tabla 2) en condiciones controladas de laboratorio.
Tabla 1 Área superficial convexa de las valvas con el software FIJI-ImageJ
| Área mm2* | Mean (mm) | StdDev (%) | Min (mm) | Max (mm) | Perim (cm) | Cobertura %** | |
| 4334,8 | 1924,13 | 3,718 | 1010 | 2320 | 24,903 | 15,71 | |
| 3987,5 | 1855,63 | 4,242 | 1100 | 2300 | 24,002 | 16,25 | 25Bay |
| 4688,8 | 1772,42 | 3,335 | 1180 | 2220 | 25,882 | 13,52 | |
| 4225,8 | 1967,45 | 4,356 | 1200 | 2450 | 24,783 | 18,82 | |
| 4278,6 | 1858,47 | 4,33 | 1200 | 2540 | 24,903 | 16,23 | 25AyB |
| 4856,1 | 1800,88 | 4,248 | 1200 | 2540 | 26,298 | 17,71 | |
| 6166,5 | 1816,61 | 4,42 | 1120 | 2210 | 29,653 | 43,95 | |
| 5157,4 | 2027,53 | 4,565 | 1120 | 2500 | 27,32 | 52,85 | 50Bay |
| 5133,6 | 2019,66 | 4,113 | 1120 | 2440 | 27,284 | 49,74 | |
| 4776,2 | 2075,36 | 3,264 | 1140 | 2450 | 26,197 | 25,65 | |
| 5513,4 | 1847,96 | 2,645 | 1140 | 2430 | 28,241 | 25,78 | 50AyB |
| 4721,2 | 1826,28 | 3,146 | 1140 | 2440 | 26,386 | 32,48 | |
| 4924,7 | 2053,7 | 4,378 | 1140 | 2360 | 26,661 | 48,84 | |
| 4683,5 | 1959,59 | 4,629 | 1140 | 2370 | 25,863 | 45,48 | 100AyB |
| 4920,3 | 1800,97 | 4,32 | 1140 | 2140 | 26,601 | 54,93 | |
| 4352,8 | 1895,92 | 2,325 | 1150 | 2140 | 25,107 | 71,56 | |
| 5040,9 | 2069,48 | 4,316 | 1150 | 2330 | 27,04 | 61,52 | 100Bay |
| 5168 | 2038,55 | 3,142 | 1150 | 2280 | 27,636 | 56,19 | |
| 6694,3 | 2124,95 | 3,146 | 1170 | 2480 | 31,068 | 1,9 | |
| 5992,8 | 1875,12 | 3,453 | 1170 | 2360 | 29,307 | 1,72 | Control |
| 5219 | 1887,66 | 2,107 | 1170 | 2280 | 27,727 | 2,82 |
Tabla 2 Parámetro de crecimiento de la fase inicial de la conchocelis de P. columbina
| Tratamientos | T° (°C) | µmol m-2 seg-1 | Salinidad (PSU) | Conduc tividad (mS) | TDS (ppt) | Soluciones |
| 25% - 1 | 15,01 | 16,1 | 36 | 55,887 | 25,9 | |
| 25% - 2 | 15,02 | 16,2 | 36,2 | 56,197 | 26,6 | |
| 25% - 3 | 15,03 | 15,7 | 36,1 | 56,042 | 27,7 | |
| 50% - 1 | 15,02 | 15,8 | 36,01 | 55,902 | 25,2 | Solución Hidropónica AyB La Molina |
| 50% - 2 | 15,02 | 16,4 | 36,05 | 55,965 | 25,2 | |
| 50% - 3 | 15,03 | 15,7 | 36,04 | 55,949 | 25,1 | |
| 100% - 1 | 15,02 | 15,8 | 36,08 | 56,011 | 26,5 | |
| 100% - 2 | 15,04 | 15,8 | 36,03 | 55,934 | 26,6 | |
| 100% - 3 | 15,03 | 15,9 | 36,02 | 55,918 | 25,6 | |
| 25% - 1 | 15,02 | 15,7 | 36,01 | 55,874 | 27,1 | |
| 25% - 2 | 15,03 | 15,8 | 36,04 | 55,921 | 27,8 | |
| 25% - 3 | 15,02 | 16,1 | 36,05 | 55,936 | 27,2 | |
| 50% - 1 | 15,03 | 16,2 | 36,05 | 55,936 | 26,8 | |
| 50% - 2 | 15,02 | 15,7 | 36,06 | 55,952 | 26,7 | Bayfolan® |
| 50% - 3 | 15,03 | 15,8 | 36,05 | 55,936 | 24,9 | |
| 100% - 1 | 15,04 | 15,9 | 36,04 | 55,921 | 25,3 | |
| 100% - 2 | 15,03 | 15,8 | 36,01 | 55,874 | 26,1 | |
| 100% - 3 | 15,03 | 16,2 | 36,03 | 55,905 | 24,8 | |
| blanco - 1 | 15,01 | 16,1 | 36,04 | 55,908 | 25,1 | |
| blanco - 2 | 15,02 | 15,9 | 36,06 | 55,939 | 26 | Control |
| blanco - 3 | 15,04 | 16,0 | 36,07 | 55,954 | 26,1 | |
| DesviaStand | 0,009 | 0,21 | 0,042 | 0,070 | 0,920 | |
| Promedio | 15,03 | 15,93 | 36,05 | 55,95 | 26,11 |
Tomando en cuenta los principales problemas del cultivo intensivo en tanques al aire libre o cerrado, como la estructura del sistema de cultivo, las características de agua de mar, la estructura del sistema; se destacó, la salinidad, características de la luz y la temperatura de aclimatación de 15 °C durante todos días de experimentación (Carmona et al., 2006), lo cuales influyeron en la composición bioquímica, el estado fisiológico y estructura. Por otro lado, con igual relevancia estuvieron presentes las variables biológicas como la densidad de algas, la competencia de epífitas, pastaje por herbívoros o la contaminación bacteriana (Freidlander & Levy, 1995).
Absorción de Nitrato
Se analizó la tasa de absorción de nitrato (𝑁𝑂−) con tratamientos de diferentes porcentajes: 0 (control), 25, 50 y 100 por ciento. Los resultados de absorción de Nitrato en 𝑚𝑀 tuvieron un comportamiento de crecimiento exponencial. De aquí en adelante el fertilizante Bayfolan® tendrá la abreviatura “Bay” y la solución hidropónica A y B La Molina, será “AyB”. Las macroalgas tienen la capacidad de utilizar, absorber y metabolizar rápidamente diferentes formas de nitrógeno inorgánico, principalmente nitrato y amonio, dependiendo de su disponibilidad. Sin embargo, la presencia de estos compuestos nitrogenados pueden ser tóxicos o inhibidores para algunas algas marinas en altas concentraciones (Lobban & Harrisson, 1994).
Las absorciones de nutrientes varían con factores físicos, químicos y biológicos. En particular, la luz y la temperatura que influyen en las tasas de absorción de nutrientes (Harrison & Hurd, 2001). Se trabajó con una temperatura promedio de 15,03 °C y fotones μmol m-2 s-1 de 15,93. Estas dos variables influyen en las tasas de absorción de nutrientes. La absorción de nitrato (𝑁𝑂−) por parte de las algas, depende de la luz (periodos), mientras que el amonio (𝑁𝐻+) puede ser menos depen- diente de la luz (Lobban & Harrison, 2004). En la Figura 1-a se observa la absorción del nitrato 𝑚𝑀 por conchocelis en un periodo de 400 h a 800 h, luego comienza la meseta decreciente. Las diferentes concentraciones de Bay al 100%, 50% y 25% fueron 0,165; 0,083 y 0,041 de nitrato en 𝑚𝑀 respectivamente.
Según Romo et al. (2005), para el cultivo en invernadero de conchocelis se adiciona el nutriente el abono agrícola Bayfolan® (0,1 ml por litro de agua de mar). El presente estudio se centró en el seguimiento del nitrato en un tiempo de 1600 horas con la concentración de stock de 41 g/L de nitrato (𝑁𝑂− − 𝑁) (NO3--N), 47 g/L de Nitrógeno Amoniacal (𝑁𝐻+ − 𝑁) en Bayfolan®.
Adicionalmente, se cultivó in vitro, en frascos de 500 ml, concentración inicial de 0,165 𝑚𝑀 del volumen recomendado por Romo et al. (2005). Tomando en consideración que la concentración de nutrientes en el agua de mar fue determinada por el equilibrio entre la tasa de suministro de nutrientes y la demanda de esta; si la concentración de nutrientes es muy baja para el agua de mar, esta no indica que las algas mantienen una concen- tración de nutrientes limitada, moderada o severa (Harrison & Hurd, 2001).
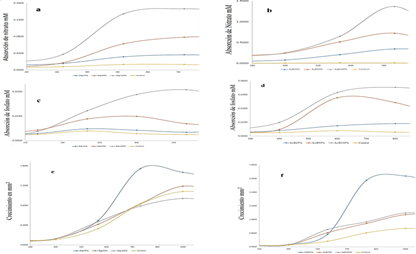
Figura 1 Absorción de nutrientes y crecimiento. a) comportamiento de la absorción de Nitrato con el fertilizante Bay. b) comportamiento de la absorción de Nitrato con el fertilizante AyB. c) niveles de absorción de fósforo para el fertilizante Bay. c) niveles de absorción de fósforo para el fertilizante. e) crecimientos con el fertilizante Bay. e) crecimientos con el fertilizante AyB. Crecimiento mm2.
Se realizó el análisis de nitrato en el agua de mar teniendo como resultado 0 mg/L, el dato inicial sirvió como referencia para la concentración inicial y así evitar la sobre saturación en el diseño experimental que pudo generar de ecotoxicidad en conchocelis.
También se puede observar que los tratamientos de 25% (0,04 𝑚𝑀), 50% (0,08 𝑚𝑀), 100% (0,15𝑚𝑀) y el control 0% (0,01 𝑚𝑀) presentan una hipérbola rectangular. La ecuación que describe esta curva se conoce como la ecuación de Michaelis Menten, V= Vmáx (S/Ks + S); donde, “S” es la concentración del nutriente, “Vmáx” es la tasa de absorción máxima, “Ks” es el valor de media saturación y "𝛼" que significa la pendiente inicial de la hipérbola rectangular V vs S.
Según Harrison & Hurd (2001), la absorción controlada internamente del nutriente está regulada por la asimilación de nitrato a amonio donde el paso de limitación de la velocidad es la conversión de nitrato a nitrito por la enzima nitrato reductasa o, en el caso del amonio, la conversión de (𝑁𝐻+) a aminoácidos. Esto ocurre dentro de conchocelis por la cantidad de nitrógeno limitado en el experimento; sin embargo, se dio una mayor cantidad de ramilletes (Romo et al., 2005) por mm2 del bivalvo debido a que la fórmula de Bayfolan® presenta la hormona de crecimiento ácido 3-indol acético al 0,00024 %w/v, donde se evidenció mayor cobertura de 63,09% de conchocelis en el bivalvo a pesar de que el nitrato es limitado, mas no, diámetro de crecimiento, este crecimiento es común cuando se agregar está hormona ácido 3- indol acético en microalgas (Portero, 2020).
Por otro lado, la solución AyB al 100, 50 y 25 por ciento como vemos en la Figura 1-b; tuvo una absorción de nitrato de 1,37; 0,73 y 0,35 𝑚𝑀 respectivamente, siendo estos los resultados con promedios más altos a diferencia del control que tiene 0,01 𝑚𝑀 de nitrato. Las concentraciones de absorción de AyB es mayor que en Bay de 100% y 50% en 8.1 veces más altas en las 200 horas de absorción; sin embargo, el de 25% fue 7,7 veces mayor. Estos resultados son mayores que los que reporta (Pedersen et al., 2004) donde reportan que HMC con 30 𝜇𝑀 de nitrato fue 7 veces mayor a 15°C que LMC con 3 𝜇𝑀 de nitrato en Porphyra s.
Absorción de Fosfato
Los resultados de los tratamientos de Bay al 100, 50 y 25 por ciento; presentaron como máxima absorción promedio de 0,0312; 0,0149 y 0,0073𝑚𝑀 respectivamente, pero en diferentes tiempos. Según la concentración usada por Romo et al. (2005) con el fertilizante líquido Bayfolan®, que tiene una concentración inicial de 0,03 𝑚𝑀 de Fosfato, la cual fue añadida en 16 recambios de medio enriquecido en toda la experimentación que tuvo un total de 1600 h, a diferentes tiempos de absorción de Fosfato; se analizó en el intervalo de 400 a 1000 h. Comenzando por el control que va desde un mínimo 400 hasta las 600 h, lo cual presenta una absorción máxima promedio de 0,0059 𝑚𝑀 de fosfato de manera natural, en la Figura 1-c podemos apreciar a los tratamientos con Bay de 100, 50, 25 y 0 por ciento, que tuvieron los tiempos de máxima absorción con 1000, 800 y 600 horas, respectivamente.
Usando un medio comercial se presentó una máxima absorción en los tratamientos de 100, 50, 25 y cero por ciento con 0,0530; 0,0417; 0,0136 y 0,0059 de fosfato 𝑚𝑀 respectivamente. Los tratamientos presentan diferentes tiempos de absorción como por ejemplo 100 y 25 por ciento, ya que presentan su máxima absorción en las 1000 horas, sin embargo, el tratamiento de 50 y cero por ciento están en las 600 horas.
Estudios en diferentes especies Porphyra purpurea, P. rosengurtii, P. leucosticta halotipo y tipo A, han utilizado diferentes rangos, mínimo de 0,5 micro- mol y máximo 3,0 micromol de fosfatos para el crecimiento de biomasa de Porphyra en su estado Gametofítica (Pedersen et al., 2004), a diferencia del experimento esporofítico. Por otro lado, la experimentación en la fase Gametofítica fue de 30 a 60 h (tiempo de absorción); sin embargo, en la etapa esporofítica se tuvo que esperar de 2 a 3 meses de crecimiento de conchocelis (Romo et al., 2005).
Área (en mm2) de crecimiento de Porphyra sp. Se ha realizado un monitoreo del crecimiento del filamento de conchocelis con el microscopio Trinocular iScope EuroMex más la cámara digital calibrada para tomar las fotos de crecimiento de los filamentos desde las 10 h luego del asentamiento hasta las 900 h, ya que la cámara no pudo evidenciar más filamentos como también se reporta en el método de Romo & Paula (1995) donde el crecimiento de conchocelis se registró semanalmente, como la frecuencia relativa de filamentos que atraviesan el diámetro ocular del microscopio.
La cantidad inicial de cigotospora fue de 125 millones por mililitro en la cual se puede evidenciar un porcentaje de germinación hasta las 1350 horas con un mínimo de 0,00003 en el control y con un máximo promedio de 0,0027 en el tratamiento de Bayfolan® como se observa en la figura 1-E, trayendo consigo la cobertura de conchocelis en 0,75±0,2248 y 7156±7,804, respectivamente, como se puede apreciar en la Figura 2.
Con un p-value < 0,05 el análisis de varianza determinó si existe diferencias significativas entre los diferentes tratamientos con el producto de Bayer Bayfolan®. Los valores obtenidos oscilan de 0,1081 a 1,5442 mm2.
Se podría evidenciar que los resultados de Bay 25% presenta mayor crecimiento de conchocelis con un 1,5442 mm2 a un tiempo 800 h presentando diferencia significativa de los demás tratamientos a pesar de tener bajo el porcentaje (25%) de la concentración que se añadió para el cultivo conchocelis trabajado por (Romo et al., 2005), así mismo tuvo una menor cobertura promedio de 15,16. Sin embargo, los tratamientos de Bay de 50, 100 por ciento y control, que tuvieron su máximo crecimiento a las 1000 h, tuvieron el área de crecimiento en 1,187; 0,939 y 1,0798 mm2 y también reportaron una cobertura promedio de 48,84; 63,09 y 0,943; respectivamente, el comportamiento de las variables se puede observar en la Figura 1-F.
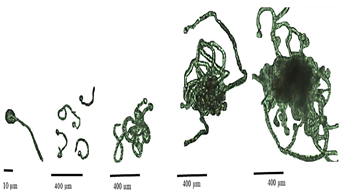
Figura 2 Crecimiento y desarrollo de la Cigotospora a Conchocelis, Pyropia sp. desde las 0 h hasta las 800 h.
Por otro lado, los valores señalados anteriormente no necesariamente indica que su tasa de crecimiento sea lo idóneo, ya que los valores en el experimento con Bayfolan difiere con el trabajo de crecimiento en hojas de Porphyra a 15 °C y con el mismo Fotoperiodo 12:12 (Hafting, 1998).
Este crecimiento de los filamentos de conchocelis para generar mayor cobertura posiblemente se deba a la hormona Ácido Indol Acético (AIA) que desató cierto “crecimiento acelerado” como se da en las algas para obtener biomasa (Portero, 2020); sin embargo, también se pudo observar el diámetro de los filamentos y son de menor radio que la solución que no tuvo hormona, solución hidro- pónica A y B La Molina.
Ambos tratamientos con 25% han desarrollado mayor tasa de crecimiento por hora; sin embargo, tienen menor cobertura de crecimiento de los filamentos sobre la valva. Así mismo, la tasa de crecimiento al 50% de Bay es aproximadamente diez veces menos que la solución hidropónica. Sin embargo, en el tratamiento de los 100% la tasa de crecimiento de Bay ha presentado decrecimiento, siendo este el de menor diámetro a diferencia de los demás tratamientos. Esta medida también es reportada en la reducción de tasa de crecimiento llamado desintegración (Hafting, 1998). Por otro lado, AyB tuvo una tasa más lenta que la de 25%. Con un p-value < 0,05 el análisis de varianza determina que si existe diferencias significativas entre los diferentes tratamientos con la fertilizante solución hidropónica AyB La Molina®. Donde la solución del 25 por ciento tuvo un mayor crecimiento de 4,1536 mm2 y un mínimo de 0,1404 mm2; por otro lado, se puede apreciar que las demás gráficas de 50, 100 y cero por ciento, no presenta la curva exponencial, pero se asume que si para poder reemplazar a la fórmula, siendo sus valores 1,886; 1,957 y 1,0798 mm2 y sus mínimos 0,1130; 0,1180 y 0,1081 mm2, respectivamente.
CONCLUSIONES
Se determinó que el crecimiento de Conchocelis, Pyropia sp presenta correlación media alta con nitrato asimilado y presenta una baja correlación con el fosfato asimilado. Además, en ambas soluciones Bayfolan y Sol. A y B La Molina, el tratamiento con 25% presentó mayor promedio de crecimiento (en mm) en el periodo de 800 horas, por esa razón, la concentración óptima para hacer cultivos en invernaderos será para crecimiento asentada de 25% de conchocelis por superficie de sustrato calcáreo. Asimismo, se determinó los efectos de Pyropia sp. en su fase conchocelis, logrando obtener un mayor diámetro de crecimiento y área de conchocelis con la solución hidropónica La Molina A y B, con un máximo de 4,15 mm2 a diferencia del fertilizante Bayfolan® que presentó menor diámetro y área a la vez de conchocelis por 1,54 mm2; sin embargo, presentó mayor porcentaje de cobertura 71,56% sobre el sustrato de Argopecten purpuratus. Cabe resaltar que, dichos resultados son base científica para futuras investigaciones de cultivos de macroalgas (fase esporofitica) in vitro para luego ser trasladadas al mar.












 uBio
uBio 


